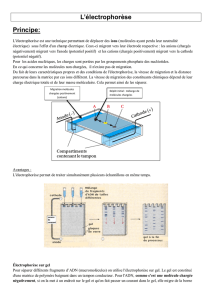
Les Gels

Les gels d’agarose et de polyacrylamide
Applications à la biologie moléculaire

L’agar-agar
Agar-agar est un mot d'origine Malaise qui désigne en extrême-orient la
gelée obtenue à partir de diverses algues rouges
gélidium
gracilaria
Au XVIIème siècle par un cuisinier Japonais. Une industrie dont le Japon conserva
seul la maîtrise jusqu'à la 2ème guerre mondiale.
Une découverte accidentelle
le gel d'agarose

De l’agar-agar à l’agarose
16 to 38 US$ /Kg
Purified Agar
38 to 60 US$ /kg
535 to 5 400 US$ /kg
agarose
Purification plus ou moins importante
Caractéristiques principales: Forme un gel à 34-43°C après ébullition
Ne se re-solubilise qu’à 85°C

L'agarose est un polymère d'un diholoside (120 000 Da)
C4
C3
C1C1
1,3-alinks are more easily hydrolysed by enzymes (Pseudomonas atlantica)
1,4-blinks are more easily hydrolysed by acid catalysts
1,4-blinks make the polysaccharide chain particularly compact and
resistant to breakage, as is found in the peptidoglycan of bacteria.

Organisation en double hélice
ZOOM -
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
1
/
37
100%