Activités du livre : stratégie et sélectivité

Terminale S www.sciencesphysiques.info
Stratégie en synthèse organique : corrections d’activités Page 1 / 4
Stratégie en synthèse organique : corrections dÊactivités
Activité documentaire n°1 page 485 : identifier les espèces chimiques mises en jeu
1. Identifier les espèces chimiques mises en jeu
Grâce aux équations de réaction, on peut déduire que :
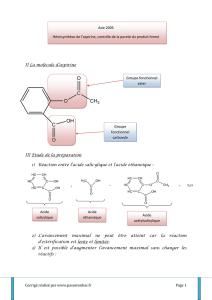
pour le protocole A : les réactifs sont l’acide salicylique (C
7
H
6
O
3
) et l’anhydride éthanoïque (C
4
H
6
O
3
)
pour le protocole B : les réactifs sont l’acide salicylique (C
7
H
6
O
3
) et le méthanol (CH
3
OH)
Protocole A : le produit d’intérêt est l’acide acétylsalicylique ou l’aspirine (C
9
H
8
O
4
) et le sous-produit est
l’acide éthanoïque (CH
3
COOH)
Protocole B : le produit d’intérêt est le salicylate de méthyle ou l’essence de Wintergreen (C
8
H
8
O
3
) et le
sous-produit est l’eau (H
2
O).
L’acide sulfurique concentré est un catalyseur. Dans l’écriture de la réaction, il apparaît sur la flèche de
transformation.
Un solvant est présent en grande quantité. Il permet de solubiliser les espèces chimiques présentes. Un réactif
peut jouer le rôle de solvant, ce sera alors le réactif en excès.
2. Déterminer les quantités de matière mises en jeu
Un litre de solution d’acide sulfurique à 98 % possède une masse de 1,84 kg. La masse de H
2
SO
4
représente
donc m = 0,98 × 1,84 = 1,80 kg, soit une quantité de matière de :
mol4,18
1,98
80,1
M
m
n ===
Espèce chimique
introduite État
physique
Masse m (g) ou
volume V (mL)
introduit
M
(g⋅mol
-1
)
Masse
volumique
(kg⋅L
-1
)
Quantité de
matière n
introduite (mol)
Acide
salicylique solide 6,0 g 138,1 - 43 × 10
-3
Anhydride
éthanoïque liquide 12 mL 102,1 1,05 123 × 10
-3
Acide sulfurique
concentré liquide 0,25 mL 98,1 1,84 4,7 × 10
-3
Les réactifs sont bien l’acide salicylique et l’acide éthanoïque. L’acide sulfurique concentré est le catalyseur,
introduit en petites quantités. Il n’y a pas de solvant introduit lors de cette synthèse. Le réactif limitant est
l’acide salicylique.
La quantité de matière d’aspirine obtenue est : mol10.34
180
2,6
M
m
n
3
aspirine
obtenue
aspirine −
===
Le rendement est défini par
thmax
obtenu
n
n
r=. Ici nmax th. = 43.10-3 mol en considérant la réaction comme totale.
Le rendement est donc égal à 79 %.
Activité documentaire n°2 page 486 : étape de transformation
1. Choix des paramètres expérimentaux
Les paramètres expérimentaux spécifiés dans les protocoles d’expérience proposés sont :
la température et la durée de chauffage lors de la transformation.
les quantités de réactifs, de catalyseur et de solvant introduites.

Terminale S www.sciencesphysiques.info
Stratégie en synthèse organique : corrections d’activités Page 2 / 4
A. Température
a. Chauffer le milieu réactionnel permet d’augmenter la vitesse de la transformation. En outre, le chauffage
permet d’accroître la solubilité des composés dans le solvant.
b. « Chauffer à reflux » signifie chauffer le milieu réactionnel à ébullition du solvant.
c. Dans le protocole A, le milieu réactionnel n’est pas chauffé à reflux (puisqu’on chauffe à 70°C alors que la
température d’ébullition de l’anhydride éthanoïque est de 139°C) contrairement au protocole B.
B. Solvant
a. Le méthanol joue à la fois le rôle de réactif et de solvant dans le protocole B. Il est introduire en très large
excès.
b. Le méthanol est un solvant polaire car la liaison O – H du groupe hydroxyde est très polarisée.
c. Le méthanol solubilise l’acide salicylique qui est un composé polaire aussi.
d. Il est nécessaire de solubiliser les espèces chimiques introduites dans le ballon afin que la transformation
s’effectue en milieu homogène et soit ainsi plus efficace (fréquence et efficacité des chocs).
e. On chauffe pour que la cinétique soit favorisée (voir partie température).
C. Durée de la transformation
a. La durée de la transformation pour le protocole B est beaucoup plus importante que pour le protocole A.
b. Cette durée peut être diminuée si l’expérimentateur joue sur les paramètres expérimentaux précédents : en
augmentant la température et en choisissant un solvant qui solubilise les réactifs. La présence d’un catalyseur
peut aussi permettre de diminuer le temps de réaction.
2. Choix du montage
a. Faire apparaître sur le schéma légendé : support élévateur, chauffe-ballon, ballon, réfrigérant à eau.
b. Pour que ce montage soit effectué en sécurité, il faut attacher le ballon grâce à une pince plate, et surtout,
il faut que le montage soit positionné sur la potence suffisamment haut, afin de pouvoir retirer le bloc de
chauffage en abaissant simplement le support élévateur.
c. Un montage de chauffage à reflux est nécessaire, car lors du chauffage, des vapeurs des espèces chimiques
présentes sont produites et sont ainsi recondensées dans le milieu réactionnel. Il n’y a ainsi pas de pertes de
produits. De plus, les vapeurs ne sont pas respirées par l’expérimentateur.
3. Aspects liés à la sécurité
a. Les équipements individuels de sécurité à porter obligatoirement au laboratoire sont : une blouse en coton
qui sera fermée et des lunettes de sécurité (même pour les porteurs de lunettes de vue, port de lentilles
interdit).
b. Pour manipuler l’acide sulfurique concentré corrosif, il faut porter des gants adaptés. Le méthanol s’utilise
exclusivement sous une hotte aspirante en prenant les précautions nécessaires à l’utilisation des produits
CMR.
c. Le fait de verser de l’acide sulfurique dans le milieu réactionnel peut provoquer un échauffement très
brusque et important de la solution qui peut s’accompagner de projections corrosives. D’où les précautions
mentionnées.
d. Pour refroidir une solution, on la plonge dans un bain de glace (mélange glace et eau en équilibre à 0°C ou
glace fondante).
Activité documentaire n°3 page 488 : étape de traitement
Protocole A
1. Choix du montage
a. Le produit d’intérêt a précipité : il est solide.
b. À la fin de la transformation, il reste dans le milieu de réaction le réactif en excès (anhydride éthanoïque),
le catalyseur (H
2
SO
4
) et aussi le réactif limitant (acide salicylique) qui n’a pas réagi.
c. Un filtre Büchner associé à une fiole à vide est utilisé pour effectuer la séparation. La fiole à vide doit être
attachée pour être utilisée en sécurité.
d. L’opération s’appelle un essorage : c’est le solide qui nous intéresse.

Terminale S www.sciencesphysiques.info
Stratégie en synthèse organique : corrections d’activités Page 3 / 4
2. Choix des techniques expérimentales utilisées
a. Le fait de refroidir le contenu du ballon permet de faire précipiter le solide voulu, la solubilité diminuant
en général avec la température. On récupère ainsi plus de produit sous forme solide.
b. Les espèces en solution sont éliminées lors des lavages sur Büchner, à savoir l’anhydride éthanoïque et le
catalyseur (H
2
SO
4
).
c. Le lavage est effectué à l’eau glacée pour que l’aspirine sur le filtre soit le moins possible redissous.
d. Placer le solide à l’étuve permet d’éliminer l’eau dont s’est imprégné le solide.
Protocole B
1. Choix du montage
L’extraction liquide-liquide s’effectue grâce à une ampoule à décanter. On y verse le mélange réactionnel
puis le solvant d’extraction. L’ampoule sortie de son support est retournée et un premier dégazage est
effectué. On agite vigoureusement l’ampoule et on dégaze à nouveau. Une fois l’ampoule reposée sur son
support et le bouchon retiré, on laisse les deux phases se séparer par décantation. On collecte les différentes
phases.
2. Choix des techniques expérimentales utilisées
a. L’opération de lavage est celle où l’on verse sur la phase organique obtenue après décantation une solution
aqueuse d’hydrogénocarbonate de sodium. Une dernière opération de lavage est effectuée avec 25 mL d’eau.
b. On récupère plus de produit d’intérêt lorsque l’on extrait deux fois avec 15 mL de solvant d’extraction
plutôt qu’une fois avec 30 mL de solvant.
c. Le lavage avec la solution d’hydrogénocarbonate de sodium permet d’obtenir un milieu neutre. Le brut
réactionnel était très acide avant lavage : H
3
O
+
+ HCO
3-(aq)
= CO
2(g)
+ 2 H
2
O
(l)
Les espèces acides sont éliminées, il y a dégagement de CO
2(g)
.
d. Le fort dégagement gazeux de CO
2
provoquerait de très fortes surpressions dans l’ampoule à décanter,
d’où un danger de projection de solution.
e. Le lavage à l’eau permet de revenir à un pH neutre. La présence d’acide ou de base pourrait gêner lors de
traitements ultérieurs du produit d’intérêt.
f. En phase organique sont présentes les espèces chimiques suivantes : le salicylate de méthyle,
éventuellement l’acide salicylique n’ayant pas réagi, le solvant cyclohexane, de l’eau à l’état de traces.
g. Un séchage est ensuite envisagé avec un sel anhydre. Puis le solvant est séparé du produit d’intérêt par
distillation grâce à un évaporateur rotatif.
Activité documentaire n°4 page 490 : étapes d’identification et de purification
1. Choix des techniques expérimentales utilisées
a. Techniques d’identification mises en œuvre :
protocole A : synthèse d’une espèce solide : mesure de température de fusion, C.C.M.
protocole B : synthèse d’une espèce liquide : mesure d’indice de réfraction.
b. Techniques de purification envisagées :
protocole A : synthèse d’une espèce solide : recristallisation + schéma du montage : ballon + réfrigérant
avec bloc de chauffage et élévateur.
protocole B : synthèse d’une espèce liquide : distillation + schéma du montage (voir classe de seconde).
2. Interpréter des résultats expérimentaux
a. Produit formé :
protocole A : synthèse d’une espèce solide. CCM : le produit brut contient un mélange d’acide
salicylique (réactif) et d’aspirine. Ceci est confirmé par l’analyse de la température de fusion du produit
brut qui est différente de celle de l’aspirine pure.

Terminale S www.sciencesphysiques.info
Stratégie en synthèse organique : corrections d’activités Page 4 / 4
protocole B : synthèse d’une espèce liquide. La mesure de l’indice de réfraction est proche de celle du
produit pur. L’analyse du spectre IR montre la présence d’un groupe caractéristique hydroxyle (présent
dans le réactif et le produit) et d’un groupe caractéristique C=O. Étant donné le nombre d’onde, on peut
conclure à la présence d’une fonction ester.
L’impureté majoritaire est l’acide salicylique dans les deux cas.
b. Pour le protocole A, il est nécessaire de purifier le produit brut obtenu, pas dans le cas du protocole B.
La réalisation d’une C.C.M. peut être envisagée pour confirmer la pureté du produit pour le protocole B,
ainsi que la réalisation d’un spectre RMN.
3. Faire une recherche
Le but d’une recristallisation est de purifier un produit brut solide. La recristallisation est basée sur la
différence de solubilité à chaud et à froid du produit d’intérêt et de l’impureté (réactif en général) dans un
solvant donné.
Activité documentaire n°5 page 491 : étapes d’identification et de purification
1. Analyse des documents
a. Protocole A :
Protocole B :
b. Protocole A : alcool isoamylique à 0,32 € ; acide éthanoïque à 1,12 € ; APTS à 0,21 € ; soit un total de
1,65 €.
Protocole B : éthanoate de potassium à 0,25 € ; acide éthanoïque à 0,30 € ; bromure d’isoamyle à 0,43 € soit
un total de 0,98 €.
c. Avant de manipuler les espèces chimiques mises en jeu, il faut regarder les pictogrammes de sécurité pour
savoir quels équipements utiliser. Ici, il faut travailler avec gants, lunettes et blouse.
d. On oublie souvent le coût et l’aspect lié à la sécurité des déchets chimiques issus des manipulations. Il faut
trier les déchets et les faire éliminer correctement.
e. Pour choisir la synthèse la plus intéressante à mettre en œuvre, il faut aussi prendre en compte le
rendement de la synthèse, ceci inclut la purification éventuelle.
2. Comparer les protocoles A et B
a. L’ajout de la solution de carbonate de sodium se fait après décantation des phases organiques et aqueuse
dans le protocole A, alors que dans le protocole B la solution basique est ajoutée après l’étape de
transformation. Sinon, on retrouve dans les deux protocoles : extraction puis lavage, puis séchage et
évaporation du solvant qui sont les étapes de traitement d’une espèce en solution dans un solvant.
b. Techniques d’identification envisagées : indice de réfraction (A, B), C.C.M. (B).
c. A priori, les deux sont réalisables. Pour le temps d’un TP en classe, le protocole A est plus adapté car la
durée de la transformation est plus courte. Il faut faire l’expérience pour savoir quelle synthèse donne le
meilleur rendement.
APTS
+ + H
2
O
acide
éthanoïque
+ K
+
+ Br
-
+
1
/
4
100%