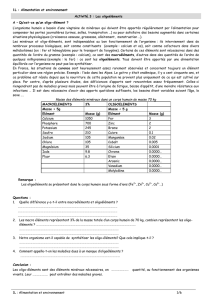
Masse des éléments minéraux dans un corps humain de masse 70

1L : Alimentation et environnement
Chapitre.3 : Les oligoéléments
A – Qu’est-ce qu’un oligo-élément ?
L’organisme humain a besoin d’une vingtaine de minéraux qui doivent être apportés régulièrement par l’alimentation pour
compenser les pertes journalières (urines, selles, transpiration …) ou pour satisfaire des besoins augmentés dans certaines
situations physiologiques (croissance osseuse, grossesse, allaitement, menstruation …).
Les minéraux et oligo-éléments, sont indispensables au bon fonctionnement de l’organisme : ils interviennent dans de
nombreux processus biologiques, soit comme constituants (exemple : calcium et os), soit comme cofacteurs dans divers
métabolismes (ex : fer et hémoglobine pour le transport de l’oxygène). Certains de ces éléments sont nécessaires dans des
quantités de l’ordre du gramme (exemple : calcium), ce sont des macroéléments, d’autres dans des quantités de l’ordre de
quelques milligrammes (exemple : le fer) : ce sont les oligoéléments. Tous doivent être apportés par une alimentation
équilibrée car l’organisme ne peut pas les synthétiser.
En France, les situations de carence sont heureusement assez rarement observées et concernent toujours un élément
particulier dans une région précise. Exemple : l’iode dans les Alpes. Le goitre y était endémique, il y a cent cinquante ans, et
ce problème est résolu depuis que la nourriture de cette population ne provient plus uniquement de ce qui est cultivé sur
place. Par contre, d’après plusieurs études, des déficiences d’apports sont rencontrées assez fréquemment. Celles-ci
n’engendrent pas de maladies graves mais peuvent être à l’origine de fatigue, baisse d’appétit, d’une moindre résistance aux
infections … Il est donc nécessaire d’avoir des apports quotidiens suffisants, les besoins étant variables suivant l’âge, le
sexe ….
Masse des éléments minéraux dans un corps humain de masse 70 kg
MACROELEMENTS
3%
OLIGOELEMENTS
Masse > 5g
Masse < 5 g
Elément
Masse (g)
Elément
Masse (g)
Calcium
1050
Fer
3
Phosphore
700
Zinc
2
Potassium
245
Brome
2
Soufre
210
Cuivre
0.1
Sodium
105
Manganèse
0.02
Chlore
105
Cobalt
0.005
Magnésium
35
Silicium
0.0001
Iode
9.8
Chrome
0.0000…
Fluor
6.3
Etain
0.0000…
Arsenic
0.0000…
Vanadium
0.0000…
Molybdène
0.0000…
Remarque :
Les oligoéléments se présentent dans le corps humain sous forme d’ions (Fe2+, Zn2+, Cu2+, Ca2+…)
Questions :
1. Quelle différence y a-t-il entre macroéléments et oligoéléments ?
Les oligoéléments sont des éléments minéraux présents dans l’organisme en quantité infinitésimale.
Les macroéléments sont eux présents en quantité beaucoup plus importante.
2. Les macroéléments représentent 3% de la masse totale d’un corps humain de 70 kg, combien représentent
les oligo-éléments ?
D’après le tableau ci-dessus, on peut calculer le pourcentage en masse des oligoéléments présents dans un corps
humain de 70 kg :
Somme des masses des oligoéléments 7 g
Pourcentage en masse = 7.10-3
70 x 100 = 0,01
On estime le pourcentage en masses oligoéléments présents dans un corps humain à environ 0,01%.
3. Notre organisme est-il capable de synthétiser les oligo-éléments? Que cela implique-t-il ? Comment appelle-t-on les
maladies dues à un manque d’oligoéléments ?
L’organisme humain est incapable de synthétiser les oligoéléments. Cela implique leur apport quotidien par une
alimentation équilibrée.
Le manque d’oligoéléments se traduit par des carences.
Conclusion :
Les oligo-éléments sont des éléments minéraux nécessaires, en très faible quantité, au fonctionnement des organismes
vivants. Leur carence peut entraîner des maladies graves.

B – Des oligo-éléments : Où ? Combien ? Pourquoi ?
Elément
Quelques fonctions
Carence
Quelques sources alimentaires, toxicologie
Fer
Composant essentiel de
l'hémoglobine
(transporteur d'O2),
permet l'apport d'O2 aux
cellules et l'évacuation du
CO2
Fatigue profonde,
baisse de
l'immunité, conduit à
l'anémie ferriprive.
Apport quotidien : 10 à 50 mg/jour
Sources :
- Légumes secs (8 à 10 mg/100g)
- Epinards (4 à 30 mg/100g)
- Viande de bœuf (3 mg/100g)
- Foie (6 à 10 mg/100g)
- Vin (2 à 6 mg/100g)
Zinc
Participe à toutes les
étapes métaboliques,
cicatrisation, antioxydant,
indispensable à la
croissance à la reproduction
et au système nerveux
Baisse des
performances
physiques, fatigue,
irruption cutanée,
inflammation,
allergie, toxique à
hautes doses,
renouvellement plus
lent des cellules,
cicatrisation ralentie,
Apport quotidien recommandé : 15 mg/jour
Sources :
- Les produits de la mer (huîtres, poissons)
- Le foie
- Les céréales (pain complet)
- Les œufs
La toxicité du zinc est faible
Cuivre
Facilite l'absorption du fer
des aliments. Concentré
dans les tissus nerveux, le
foie, le cœur, les reins,
nécessaire au
fonctionnement du système
nerveux
Chute de l'immunité
et anémie, les
carences sont rares!
altération du goût
Apport quotidien recommandé :1 à 2 mg/jour
Sources :
- coquillages
- cacao, légumes secs
- foie
Toxicité modérée : DJA* fixé à 0,5 mg de Cu par
kg.
Attention, parfois présent dans le vin ou dans
certaines eaux (canalisations en cuivre)
Manganèse
Essentiellement présent
dans le foie, les reins, le
pancréas et le cerveau.
Participe à l'équilibre de
nombreux enzymes,
métabolisme des glucides.
Retard de croissance
cérébrale chez le
fœtus, baisse de
glycémie, troubles
articulaire
Apport quotidien : 7 mg/jour
Sources :
- céréales complètes
- graines oléagineuses
Chrome
Présent dans le squelette
Régulateur du taux de sucre
dans le sang et contrôle le
taux de cholestérol sanguin
Sa carence intervient
dans l’apparition de
certains types de
diabète.
Apport quotidien recommandé :
50 à 200 µg/jour.
Sources :
- jaune d’œuf
- foie
- huîtres
- viande de bœuf
Attention : le chrome(VI), présent dans certains
rejets industriels accidentels est très toxique
(cancers, modifications génétiques..)
Cobalt
Présent dans la molécule de
vitamine B12
Pas de carence
connue
Apport quotidien : 0,1µg/jour
Coquillages, champignons, lentilles, ris de veau
Métal toxique
Sélénium
Sert d’antioxydant
Recrudescence
possible de cas de
cancers et
d’insuffisance
cardiaque.
Apport quotidien : 50 μg/jour
Sources :
- produits de la mer
- noix
- champignons
Toxique au delà de 500 μg/jour
*DJA : dose journalière admissible

Questions:
1. Quels aliments peut-on conseiller à une personne souffrant de fatigue passagère ?
Une fatigue passagère est souvent liée à un manque en oligoélément fer (Symbole chimique : Fe).
ce manque peut être palier par une consommation d’aliments riches en fer : viandes rouges, légumes secs,
épinards…
2. Sachant que 100 g de viande de bœuf apporte 3 mg de fer, quelle quantité de viande bœuf faudrait-il manger par jour
pour absorber la dose recommandée de fer ? Quels sont les risques encourus par une personne suivant un régime
végétarien ?
L’apport quotidien en fer, d’après le tableau ci-dessus est de 10 à 50 mg.
La quantité de bœuf qu’il faut consommer par jour est d’environ entre 10
3 x 100 = 330 g et 50
3 x 100 = 1670 g
Une personne végétarienne risque une carence en fer.
3. A l’aide des questions précédentes, pourquoi faut-il varier son alimentation ?
La variation de l’alimentation permet d’avoir un apport quotidien des différents oligoéléments.
4. Quels aliments peuvent être déconseillés aux personnes souffrant d’insuffisance cardiaque ?
D’après le tableau, une personne souffrant d’insuffisance cardiaque doit éviter une grande consommation en
aliment riche en oligoélément sélénium : produits de la mer, noix et champignons.
C – Comment mettre en évidence les oligo-éléments ?
Les aliments contiennent des oligo-éléments en très faible quantité, ce qui suffit à satisfaire nos besoins. Pour notre santé,
il faut équilibrer notre alimentation, il est donc nécessaire de mettre en évidence les oligo-éléments présents dans les
aliments:
Effectuer chaque test, en introduisant dans un tube à essai environ 1 cm3 de solution contenant l’ion à caractériser
puis environ 1 cm3 de réactif.
Compléter le tableau ci-dessous :
Ion à
caractériser
Solution
Réactif
Résultat du test
cuivre Cu 2+
Sulfate de cuivre à 10-2 mol/L
Soude (hydroxyde de sodium)
Positif
Sulfate de cuivre à 10-4 mol/L
Négatif
fer (III) Fe 3+
Chlorure de fer à 10-2 mol/L
Solution de thiocyanate de potassium
Positif
Chlorure de fer à 10-4 mol/L
Négatif
Questions :
1. Peut-on toujours détecter la présence d’oligo-éléments dans une solution ? …
Si la concentration d’une solution est très faible en ion cuivre ou en ion fer (III), il est impossible de détecter
leur présence.
2. Peut-on mettre en évidence les oligo-éléments contenus dans les aliments à l’aide de ces tests ?
De simples tests ioniques ne permettent pas de détecter la présence d’oligoéléments dans les aliments, car leur
quantité est extrêmement faible.
Conclusion :
Avec des solutions de faibles concentrations les tests ne sont pas positifs. On ne peut donc pas mettre en évidence, par
l’intermédiaire de ces tests, la présence d’oligo-éléments dans les aliments, les quantités présentes étant extrêmement
faibles. D’autres méthodes, plus précises doivent être utilisées.

D – Dosage du fer dans le vin blanc
L'élément fer est naturellement présent dans le raisin et donc dans le vin.
On cherche à mettre en évidence et à doser l’élément fer, présent dans le vin en très faible quantité. Ce fer est sous
différentes formes ioniques : à l’état Fe3+, mais aussi partiellement à l’état Fe2+.
1/ Préparation des solutions étalons
A partir d’une solution mère contenant 100 mg d’ions fer III par litre, on prépare 50 mL de solutions à 2 ; 4 ; 6 ; 8 ; 10 ; 12 ;
14 et 16 mg/L.
N° de la solution
1
2
3
4
5
6
7
8
Concentration (Fe3+) (en mg/L)
2
4
6
8
10
12
14
16
2/ Réalisation de l’échelle de teintes
On utilise alors 8 tubes à essais, numérotés de 1 à 8, et on verse dans le tube n°k :
10mL de solution étalon préparée n°k (prélevés à la pipette jaugée)
1mL de solution d’acide chlorhydrique (prélevés à la seringue)
1mL de solution de thiocyanate de potassium (prélevés à la seringue)
1 mL gouttes d’eau oxygénée.
Agiter.
On obtient ainsi 8 solutions de même volume ayant une couleur rouge de plus en plus intense, contenant des quantités
connues d’ions fer III.
Principe de l’échelle de teinte :
Plus la concentration en fer est faible, plus la couleur de la solution devient claire.
3/ Dosage des ions fer III dans le vin
Pour doser le fer présent dans un vin blanc, puisqu’il est initialement légèrement coloré, on le décolore par filtration sur noir
de carbone.
On verse ensuite dans un 9ème tube à essais :
10mL de vin blanc décoloré (prélevés à la pipette jaugée)
1mL de solution d’acide chlorhydrique (prélevés à la seringue)
1mL de solution de thiocyanate de potassium (prélevés à la seringue)
1mL gouttes d’eau oxygénée.
En comparant la couleur de la solution obtenue dans ce tube avec l’échelle de teinte, on constate que sa couleur est comprise
entre celle du tube n° 6 et celle du tube n° 7.
Conclusion :
D’après la couleur obtenue pour le vin blanc, on en déduit que la concentration en Fe3+ dans le vin blanc est entre
12 et 14 mg.L-1

1L : Alimentation et environnement Les oligoéléments
Exercices d’application
CORRECTION
Exercice.1 : Lutte contre les carences
L’organisation mondiale de la santé (OMS) estime que 600 à 700 millions de personnes souffrent de carence en fer, les
conséquences sont importantes, car le fer permet à l’hémoglobine (pigment rouge du sang) de transporter correctement
l’oxygène à toutes les cellules du corps. Les individus végétariens peuvent présenter une carence en fer qui se traduit par
une anémie, dont le principal symptôme est la fatigue.
1. Quel est l’oligoélément cité dans le texte ? Donner son symbole chimique.
Il s’agit de l’oligoélément. Son symbole chimique est Fe.
2. Quel est son rôle dans l’organisme ?
Le fer permet à l’hémoglobine du sang de transporter l’oxygène à toutes les cellules de l’organisme.
3. A votre avis, pourquoi les individus végétariens ont-ils un risque de présenter une carence en fer ?
Les individus végétariens ne consomment pas de viande, aliment riche en élément fer, et perdent du sang lors de
la période des règles (pour les femmes), elles présentent alors des risques de carence en fer.
4. Comment peuvent-ils y remédier ?
Pour y remédier, elles peuvent consommer des légumes secs, des épinards ou des compléments alimentaires
contenant du fer.
Exercice.2 : Le zinc dans l’organisme
Le corps d’un adulte contient environ 2 à 3 g de zinc. Le zinc est un élément très utile à l’organisme, il intervient dans le
processus de multiplication cellulaire (croissance), il entre dans la composition de nombreuses enzymes aux actions diverses
(synthèse des protéines), il permet l’action de nombreuses hormones (de croissance, du goût), et il joue aussi un rôle
d’antioxydant puissant. On le trouve dans de nombreux aliments d’origine animale.
Pour un homme adulte, les besoins journaliers en zinc sont de 15 mg.
1. Quelles sont les données du texte qui indiquent que le zinc est un oligoélément ?
2. Quels peuvent être les effets d’une carence en zinc ?
3. Donner deux exemples d’aliments à consommer en cas de carence en zinc.
1. Le corps d’un adulte contient 2 à 3 g de zinc, cette quantité est inférieure à 5 g.
L’apport journalier en zinc est de 15 mg. Il s’agit bien d’un oligoélément.
2. Une carence en zinc peut provoquer des problèmes de croissance, et des disfonctionnements hormonaux.
3. La viande et le poisson contiennent du zinc.
Exercice.3 : Dosage des ions fer dans un comprimé de médicament
On fait réagir les ions fer Fe2+ contenu dans un comprimé, avec une solution violette de permanganate de potassium.
On procède de la manière suivante : Voir schéma ci-dessous
On écrase un comprimé que l’on dissout dans 50 mL d’eau distillée.
On verse ces 50 mL dans un bécher.
On remplit une burette graduée, en ajustant le zéro, de la solution de permanganate de potassium.
On place le bécher précédent, muni d’un agitateur magnétique, sous la burette.
On verse progressivement la solution violette de permanganate de potassium dans le bécher, on observe que la
couleur violette disparaît.
 6
6
 7
7
1
/
7
100%