Chimie - Collège Notre

Collège Notre-Dame Classe de 1ère S
de Jamhour Année 2008-2009
Département de Chimie
Programmation prévisionnelle
1er semestre
Chapitres
1 – Mesurer des quantités de
matière. (partie
commune)(3 semaines).
2 – Les solutions
électrolytiques. (partie
commune)
(2 semaines).
Objectifs
- Déterminer une quantité de matière à
partir de la masse d’une substance ou
du volume d’un liquide ou d’un gaz.
- Déterminer une quantité de matière à
partir de la concentration et du volume
d’une solution.
- Transformer le pourcentage
massique d’une solution en
concentration molaire et inversement.
- Réaliser et décrire le mode opératoire
de la préparation d’une solution de
concentration donnée.
- Réaliser et décrire le mode opératoire
de la préparation d ‘une solution par
dilution d’une solution mère.
- Ecrire l’équation de dissolution d’un
composé dans l’eau.
- Connaître la cause et la conséquence
du caractère dipolaire d’une liaison
covalente.
- Décrire le phénomène de solvatation
des ions.
- Calculer la concentration d’une
espèce en solution dans un mélange de
solutions.
Activités
- TP : Préparation de
solutions aqueuses
- TP: Préparation et
utilisation d'une échelle de
teinte.
3 – Analyse qualitative.
(partie commune)
(1 semaine).
- Choisir, décrire et réaliser le test
d’identification d’un ion susceptible
de se trouver en solution.
- Interpréter un document (schémas ou
texte) pour en déduire la présence ou
l’absence d’un ion dans une solution.
- TP: Identification d une
espèce chimique en solution
et identification d'une
solution.

4 – Etude des transformations
chimiques. (partie
commune)
(4 semaines).
5 – La conductimétrie.
(bac français) (3 semaines).
6 – Les réactions acido-
basiques. (partie commune)
(2 semaines).
- Utiliser l’avancement pour étudier
l’évolution d’un système.
- Déterminer à l’aide du tableau le
réactif limitant, l’avancement maximal
et les quantité de matière présentes en
fin de réaction.
- Utiliser les rapports de
proportionnalité pour déterminer le
réactif limitant.
- Calculer la quantité de matière d’un
réactif restant ou d’un produit.
- Définir la conductance et la
conductivité d’une solution.
- Décrire le montage expérimental et
le mode opératoire de la mesure de la
conductance d’une portion de solution.
- Utiliser la relation entre la
conductivité d’une solution diluée et
les conductivités molaires ioniques des
ions présents pour déterminer une
concentration inconnue.
- Utiliser le graphe G=f(C) pour
déterminer la concentration inconnue
d’une solution.
- Définir un acide fort et une base
forte.
- Définir un acide et une base d’après
Bronsted.
- Définir un couple acide / base et
l’écrire sous forme d’équation.
- Connaître la relation entre la couleur
de l’indicateur coloré dans une
solution et le pH de cette solution.
- Retenir quelques couples acide / base
et écrire l’équation d’une réaction
acido-basique.
-TP : Etude d’une
transformation chimique.
- TICE : Etude de
transformations chimiques.
- TP : Détermination de la
concentration du chlorure de
sodium dans un sérum
physiologique.
- TP: Réactions acido-
basiques.

2ème semestre
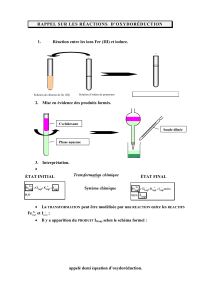
7 – Les réactions
d’oxydoréduction. (partie
commune) + (bac libanais)
(4 semaines).
8 – Les dosages. (partie
commune) + (bac français)
(3 semaines).
- Définir oxydant, réducteur,
oxydation, réduction et réaction
d’oxydoréduction.
- Définir un couple redox, l’écrire sous
forme ox / red ou sous forme
d’équation.
- Utiliser la classification
électrochimique des couples pour
prévoir une réaction redox.
- Définir la demi-pile à hydrogène et le
potentiel d’oxydoréduction d’un
couple.
- Prévoir une réaction
d’oxydoréduction en appliquant la
règle de gamma.
- Décrire le montage expérimental et
le mode opératoire d’un dosage
colorimétrique acido-basique.
- Décrire le montage expérimental et
le mode opératoire d’un dosage redox.
- Décrire le montage expérimental et
le mode opératoire d’un dosage
conductimétrique.
- Définir l’équivalence et la déterminer
dans différents types de dosage.
- Exploiter un dosage pour déterminer
la concentration d’une espèce en
solution.
- TP: Les réactions
d'oxydoréduction.
- TP: Dosage colorimétrique
d’un détartrant à cafetière.
- TP: Dosage
conductimétrique d’un
vinaigre.
9 – La chimie organique :
Analyse élémentaire (partie
commune)
(1 semaine).
9’ – Le squelette carboné.
(partie commune)
(1 semaine).
10- Les alcanes et les
alcènes. (partie commune)
(2 semaines).
- Définir un composé organique.
- Déterminer la composition massique
centésimale d’un composé organique
ainsi que sa formule moléculaire ou
empirique.
- Ecrire la formule développée, semi-
développée ou topologique d’un
composé organique.
- Reconnaître une chaîne carbonée
cyclique, non cyclique, linéaire ou
ramifiée.
- Reconnaître un alcane et un alcène
aliphatique à partir de sa formule
moléculaire.

11- Les groupes
caractéristiques (partie
commune) (1 semaines).
- donner la nomenclature officielle, les
formules semi-développées des
isomères et reconnaître les isomères
des alcanes et alcènes.
- Décrire les propriétés physiques et
chimiques des alcanes. Ecrire les
équations des réactions de substitution.
- Décrire les propriétés physiques et
chimiques des alcènes. Ecrire les
équations des réactions d’addition.
- Reconnaître et retrouver les isomères
de constitution et les stéréoisomères de
configuration de type Z-E (dans le cas
des alcènes)
- Reconnaître et identifier les groupes
caractéristiques dans une molécule
organique.
- TP : Identification des
groupes caractéristiques.
1
/
4
100%