Modèle microscopique du gaz parfait, pression et température

I Modèle du gaz parfait
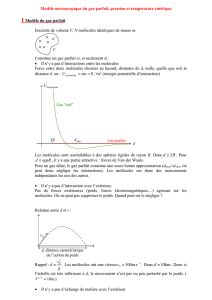
Enceinte de volume V, N molécules identiques de masse m.
V
Constitue un gaz parfait si, et seulement si :
Il n’y a pas d’interactions entre les molécules
Force entre deux molécules choisies au hasard, distantes de d, nulle, quelle que soit la
distance d. ou :
0cte
ninteractio U
,
d
(énergie potentielle d’interaction)
Uinteraction
d
2Rdvdw Gaz parfait
Gaz "réel"
Les molécules sont assimilables à des sphères rigides de rayon R. Donc
Rd 2
. Pour
Rd qqs
, il y a une partie attractive : forces de Van der Waals.
Pour un gaz dilué, le gaz parfait constitue une assez bonne approximation (dmoy>dvdw, on
peut donc négliger les interactions). Les molécules ont donc des mouvements
indépendants les uns des autres.
Il n’y a pas d’interaction avec l’extérieur.
Pas de forces extérieures (poids, forces électromagnétiques…) agissant sur les
molécules. On ne peut pas supprimer le poids. Quand peut-on le négliger ?
Relation entre d et v :
v0
d, distance caractéristique
de l’action du poids
Rappel :
g
v
d2
0
. Les molécules ont une vitesse
1
0m.s300
v
. Donc
km10d
. Donc
si l’échelle est très inférieure à d, le mouvement n’est pas ou peu perturbé par le poids. (
m10
3/1 V
)
Il n’y a pas d’échange de matière avec l’extérieur
Modèle microscopique du gaz parfait, pression et température cinétique

L’enceinte est un système fermé.
Exemple d’enceinte non fermée (il y a échange de matière entre les phases) :
V
Eau liquide
Eau vapeur
II Calcul de la pression cinétique
A) Hypothèse du chaos moléculaire
1) Agitation thermique
Les molécules sont animées de mouvements désordonnés et incessants.
2) Homogénéité de la densité moléculaire
Définition :
),( tMnv
densité moléculaire ou volumique de particules.
V
mésoscopique
N
Nombre de molécules dans
V
mésoscopique :
N
V
N
tMnV
),(
. Pour une répartition homogène :
V
N
tnV)(
.
3) Homogénéité et isotropie de la distribution des vitesses
Isotropie (de la distribution des vitesses) :
Toutes les directions de l’espace sont équivalentes (en particulier, pas de
mouvement d’ensemble des particules, c'est-à-dire pas d’écoulement)
Homogénéité de la distribution des vitesses :
Les vitesses sont indépendantes de la position des particules dans l’enceinte
Variante simplifiée de l’homogénéité et de l’isotropie de la distribution des
vitesses : une molécule i dans l’enceinte a une vitesse
i
v
telle que
0
,vvi i
, et,
dans un repère
),,,( kjiO
,
ivvi
0
ou
jv
0
ou
kv
0
. On a donc un même
module de vitesse pour toute molécule, constant où qu’elle soit (homogénéité), et
la probabilité d’une des vitesses est de 1/6 (isotropie).
B) Calcul de la pression cinétique
1) Interprétation microscopique de la pression

dS, élément de la paroi
gaz
iPdSFd
.
Les chocs incessants entre les molécules et la paroi se traduisent par
l’existence d’une force (de pression) exercée par ces molécules sur la paroi.
2) Force pressante et percussion
(Avec variante simplifiée)
x
Paroi dS
iv
0
Seules les molécules ayant une vitesse
iv
0
pourront avoir un choc avec la
paroi et auront alors une vitesse
iv
0
après le choc.
D’après la relation fondamentale de la dynamique (dans Rlab galiléen) :
idS
iF
dt
vd
m/
(seule force appliquée à la molécule)
iF idS
/
t
tt
tfin
tdébut
très petit
imvtvtvmvdmdtFii
t
ti
t
tidS
0débutfin/ 2))()((
fin
début
fin
début
La molécule exerce sur dS une force
idSdSiFF //
. Donc
imvdtF
t
tdSi
0/ 2
fin
début
(percussion individuelle de la molécule i).
ttttt findébut
. Donc
imvdtF
tt
tdSi
0/ 2
.
imvN
itPdS
dtiPdSdtFdtFdtFtt
t
tt
t
tt
tdSi
tt
i
tt
tdSi
0
pression/
et t entre choc unont qui /
2
Donc
(où
N
est le nombre de chocs entre t et
tt
), soit donc
0
2mvNtPdS
.

3) Evaluation de
N
.
iv
0
iv
0
)(tM
)( ttM
tv
0
dS
Les molécules avec une vitesse
iv
0
qui pourront avoir un choc avec dS
entre t et
tt
sont celles contenues dans le cylindre de base dS et de longueur
tv
0
. Volume du cylindre :
tvdSV 0
. Nombre de molécules dans ce
cylindre qui vont dans le bon sens :
tvdSnVnN VV 0
6
1
6
1
.
Donc
tvdSnmvtPdS V 00 6
1
2
.
2
0
3
1vnmP V
. Ceci est valable
pour une distribution plus réaliste (admis) :
2
*
3
1vnmP V
.
C) Température cinétique
On définit la grandeur d’état Tcinétique du système par la relation :
2
cinétique *
2
1
2
3mvkT
. m : masse d’une molécule.
k : constante de Boltzmann
a
NR/
(
11 mol.K314,8
R
,
123mol10.022,6
a
N
).
Pour une molécule i,
²
2
1
,ntranslatio, iiC mvE
. Donc
²*
2
1
²
2
1
,ntranslatio, mvmvE
i
i
i
iC
.
cinétique
2
1kT
: Énergie thermique associée à chaque degré de liberté de translation
(mouvement dans l’espace 3 degrés de liberté).
Donc
R
vM
NR vNM
k
vm
T
a
a3*
3*
3*2
2
2
cinétique
ou
m
kT
vcinétique
3
*
.
D) Equation d’état du gaz parfait
On a :
2
*
3
1vnmP V
Donc
cinétiquecinétique
2
cinétique 3/3
3*T
N
R
NPVkTnP
knP
k
vm
T
a
V
V
cinétique
.. TRnPV
Et
M
m
ngaz
.
Donc
cinétiquegazrTmPV
avec
M
R
r
: constante massique des gaz parfaits.
III Energie interne du gaz parfait
A) Gaz parfait monoatomique
Définition :
gaz parfait dont les molécules sont réduites à un seul atome = particule ponctuelle.

Energie d’une molécule :
extérieur,ninteractio,, ppici EEEE
.
Comme le gaz est parfait,
0
extérieur,ninteractio, pp EE
. Donc
2
,2
1iici mvEE
.
B) Gaz parfait polyatomique
Définition :
C’est un gaz parfait dont les molécules sont constituées de plusieurs atomes.
H
H
O
interactions
rotation
translation
Donc
vibration,rotation,ntranslatio,, cccic EEEE
C) Energie interne du gaz parfait
1) Gaz parfait monoatomique
Définitions :
- Energie interne :
2
1
2
1*
2
11
2
1mvNv
N
mNEU N
ii
N
ii
Donc
cinétiquecinétique 2
3
2
3nRTkTNU
- Energie interne molaire :
cinétique
2
3RT
n
U
Um
- Energie interne massique :
cinétique
gaz
cinétique
gaz
gaz 2
31 rT
m
RT
M
m
m
U
u
-
Chaleur
ou ecalorifiqu
ou
thermique
Capacité
isochore (à V constant) :
V
VT
U
C
Pour le gaz parfait, U ne dépend que de T (indépendant de V)
On a :
nR
dT
dU
CV2
3
,
1
.
KJCV
-
R
dt
dU
Cm
Vm 2
3
,
,
11
,..
molKJC Vm
-
r
dt
du
cV2
3
,
11..
kgKJcV
Remarque : pour un gaz parfait,
TcmTnCTCU VVmV gaz,
 6
6
1
/
6
100%