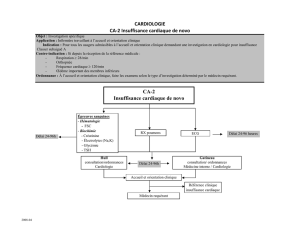
Direction - AIPM Association des Internes en Pharmacie de Marseille

S
Sa
ai
in
nt
t
D
De
en
ni
is
s,
,
l
le
e
1
17
7/
/0
03
3/
/2
20
01
14
4
OFFRE D’EMPLOI
2 évaluateurs cliniques (H/F)
-contrat à durée déterminée-
Présentation générale du poste
de travail
Direction
Direction des médicaments en cardiologie, endocrinologie,
gynécologie et urologie
Pôle
Pôle Cardiologie, Thrombose, Métabolisme, Obésité
Liaisons :
. hiérarchiques
. fonctionnelles
Collaborations internes
Collaborations
externes
Chef de pôle Cardiologie, Thrombose, Métabolisme, Obésité
Direction de l’évaluation
Evaluateur coordonnateur de projet et les autres évaluateurs
scientifiques (qualité pharmaceutique, conformité qualité
pharmaceutique, préclinique, contrôle de la publicité,
pharmacovigilant) de la direction.
Gestionnaire administratif de la direction.
Liens avec les demandeurs notamment les firmes pharmaceutiques
Relations avec la HAS DGS, INPES, INVS, pour les gammes
thérapeutiques prises en charge (Cardiologie, Thrombose,
Métabolisme, Obésité)
EMA – Homologues des autres agences de sécurité sanitaire de
l’Union européenne
Direction des ressources humaines

Mission
et activités
afférentes au poste
Finalité du poste
Activités
principales
Activités
secondaires
Evaluer les données d’efficacité et de sécurité clinique (demandes
d’AMM, demandes d’autorisation d’essai clinique, demandes d’ATU et
de RTU )
Instruction des dossiers de demandes d’AMM: Evaluation des
nouvelles demandes et variations selon les procédures nationales
ou européennes
Rédaction en langue anglaise des commentaires ou Rapports
d’évaluation dans le cadre des procédures Européennes
Rédaction des AMM et rectificatifs, voire des Schémas Communs
aux classes thérapeutiques gérées (procédures nationales et
européennes (PRM)
Participation au Groupe de Travail Thérapeutique des gammes
gérées : planification de l’évaluation des dossiers, présentation des
dossiers en Groupe de Travail, rédactions des documents de
synthèse (ordres du Jour/Relevés d’avis)
Evaluation des protocoles d’essais cliniques
Evaluation des demandes d’abrogation d’AMM, ruptures de stocks,
etc.
Rédaction des RaPPEs et PARs, Fiches de Synthèse, rédaction
et/ou validation de compte rendus de réunions/Commissions
Participation aux réunions de concertation/ conseil/ avis
scientifiques au développement à la demande des firmes
Réponse aux différentes saisines de la DGS, courriers du citoyen,
courrier des administrés
Traçabilité mensuelle (mise à jour) de l’activité et des indicateurs
d’activité
Participation au CHMP en fonction des sujets à l’ordre du jour
Participation à la rédaction de Guidelines Européens dans les
gammes thérapeutiques gérées
Participation à la rédaction de Bonnes Pratiques dans les gammes
gérées (en collaboration avec la HAS)
Contribution à l’Evaluation de la France des Plans d’Investigation
Pédiatriques (PIP)

Profil recherché
Diplôme requis
Docteur en médecine, en pharmacie, ou scientifique ( bac + 5
minimum) avec :
- Diplôme complémentaire CESAM
- Connaissance de l’environnement règlementaire de
l’enregistrement des médicaments
Expérience
professionnelle
requise
Expérience professionnelle dans le domaine de la Cardiologie,
Thrombose, Métabolisme, Obésité serait un plus.
Connaissance de l’évaluation des médicaments.
Compétences clés
recherchées
- Esprit d’analyse scientifique et de synthèse
- Qualités rédactionnelles
- Maîtrise de l’anglais parlé et écrit
- Maîtrise de l’outil informatique
- Travail en équipe
Caractéristiques
administratives
Type de contrat
CDD de 6 mois
Catégorie
d’emploi
CE1
Emploi repère
Evaluateur
Localisation
ANSM
143-147, boulevard Anatole France
93285 SAINT-DENIS CEDEX
Modalités de
candidature
Date limite de dépôt
des candidatures
31/03/2014
Lieu d’envoi des
candidatures
Référent technique
Lotfi Boudali
Chef de pôle Cardiologie, Thrombose, Métabolisme, Obésité
Direction des médicaments en cardiologie, endocrinologie,
gynécologie et urologie
Pierre Demolis
Directeur adjoint de la direction de l’Evaluation
Direction de l’évaluation
1
/
3
100%