Biologie cellulaire du 16 mars

1
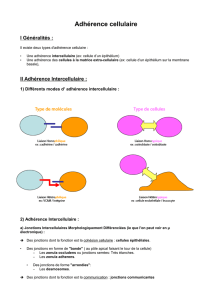
Biologie cellulaire du 16 mars : 4ème cours
Les Cell adhesion molecules (CAM)
- Molécules d’adhérence appartenant à la superfamille des immunoglobulines (IgSF)
- Les anticorps font partie des Ig (IgE, M).
- La plupart des Ig sont des protéines membranaires = transmembranaire (aucune protéine
membranaire n’est pas transmembranaire).
- Fonction primaire des Ig est dans l’adhérence cellulaire et au cours de l’évolution ils sont
devenu des anticorps (circulant).
- Lient :
-CAM
-Antigène circulant.
-Intégrines (qui peuvent dans certains cas faire interaction cellule-cellule) : impliqué
dans interactions entre leucocytes et l’endothélium.
-Protéoglycannes (protéines glycosylées) en abondance dans la MEC : modulent
l’adhérence au cours de la différenciation cellulaire ou de la coagulation. Car elles entrent en
compétition avec d’autres protéines intercellulaires. Exemple de l’héparine : anticoagulant
soluble qui entre en compétition avec d’autres molécules pour la liaison aux Ig, si elle se lie à
ces Ig membranaires, ceux ci sont empêcher de se lier aux autres cellules donc empêcher
interaction des plaquettes avec les cellules endothéliales.
La structure des CAM
-Motifs répétés C2 : retrouvés sur les Ig circulantes ou membranaires. Ce sont des boucles
formées par des cystéines qui font des ponts dissulfure quand oxydé.
-Un domaine transmembranaire + un domaine intracellulaire C terminal plus ou moins long.
-L’extrémité N terminal est impliqué dans la liaison aux PG.
-La liaison est indépendante du calcium (intracellulaire ou extracellulaire). [Pour les
molécules qui ont besoin du calcium, si on ajoute un chélateur du calcium les cellules vont
perdre l’adhérence entre elles.]
Fonctions des CAM
-Intéractions leucocytes-cellules endothéliales : donc de la réaction et réponse inflammatoire.
-Intéractions entre leucocytes et le tissu conjonctif : dans réponse inflammatoire car il faut que
les leucocytes adhèrent à la paroi des vaisseaux pour pouvoir les traverser mais « ensuite » il
faut qu’ils migrent et se fixent dans le tissu conjonctif pour exercer la phagocytose.
-Intéractions entre cellules endothéliales et tissu conjonctif : important dans l’angiogénèse
(formation des vaisseaux) qui est dû à prolifération de cellules endothéliales puis leur
arrangement donc il faut qu’elles s’accrochent au tissu conjonctif pour forme vaisseaux.
-Dans l’angiogénèse c’est : VCAM (exprimé sur cellule endothéliale), PECAM
(exprimé sur plaquettes donc impliqué dans thrombose), ICAM (Cam intercellulaire qui
interviennent dans la diapédèse des leucocytes après les sélectines).
-Intéractions entre cellules du tissu nerveux et les cellules musculaires : important pour la
formation d’axones car migration des cellules pour former la jonction neuromusculaire :
-NCAM : Cam nerveuse qui a rôle important dans développement et réparation du
système nerveux (périphérique +++).

2
Les Cadhérines
-Impliqué dans adhérence et prolifération cellulaire.
-Intéragissent avec cadhérines des cellules voisines.
-structure homodimérique formant des tirettes : dimère d’une cellule se glisse entre les dimère
de l’autre cellule.
-Intéractions calcium dépendante.
-Elles forment les jonctions d’adhérence composé d’un domaine cytoplasmique des
cadhérines qui interagit avec les caténines qui les relient aux filaments d’actine. Ces
molécules contribuent à l’ancrage du cytosquelette à la membrane : c’est important que le
cytosquelette aille de membrane jusqu’au noyau puisqu’un grand nombre de molécules de
signalisation sont activés au niveau de la membrane (par récepteur membranaire) et ensuite
sont transloquer vers le noyau (comme les MAP kinase). Si pas d’adhérence cellulaire des
signaux ne sont plus transmis vers le noyau donc les signaux prolifératifs transmis par
l’activation de la voie des MAP kinase ne vont plus être efficace car ces MAP kinase étaient
censés réguler l’expression du gène de la cycline D.
-Elles forment les desmosomes : grâce à des molécules homologues des cadhérines =
desmogléines et desmocollines qui interagissent avec des protéines cytoplasmiques qui les
relient aux filaments intermédiaire (épiderme : kératine).
-Photo d’un desmosome : la plaque cytoplasmique composé de caténine. Les cadhérines entre
les cellules.
-Modélisation des cadhérines : deux chaînes glissant avec deux autres.
-structure des cadhérines : répétition de domaines conservés (5) qui lient le calcium ce qui est
important pour maintenir la conformation 3D.
-Pemphigus bulleux : apparition de vésicules sur la peau car mutation sur cadhérines qui
perdent leur capacité d’adhérence donc la couche superficielle de l’épiderme se détache des
couches profondes. Pronostic sombre.
Organisation sur la cellule
-La cadhérine interagit avec l’α caténine, l’ α caténine et la plakoglobine = γ caténine qui a un
fort degré d’homologie avec la β caténine.
-La γ et la β caténine interagissent directement avec les cadhérines et avec l’ α caténine qui
interagit avec les filaments d’actine.
-Les α caténine interagissent jamais directement avec les cadhérines.
-P120 a une tyrosine phosphorylé. Les tyrosines kinase et phosphatase jouent un rôle dans
l’adhérence cellulaire et dans l’affinité des cadhérines.
-Complexe impliquant β ou γ caténine, l’ α caténine et APC (protéine de la polypose
adénomateuse du colon). Cette polypose est la présence de polypes adénomateux dans le
colon. Polypes sont des tumeurs malignes ou bénignes. Les adénomes sont tumeur bénigne
donc les polypes adénomateux sont des tumeurs dans la lumière du gros intestin et ces
polypes peuvent se cancériser : maladie familiale. Quelqu’un qui a ces polypes risquent de
développer un cancer du colon. Au niveau de ces adénomes des protéines sont mutés et en
particulier cette APC qui lorsqu’elle est muté perd sa fonction. APC est impliqué dans la
dégradation des caténines.
-Les caténines peuvent aussi former des hétérodimères avec TCF (facteur de transcription) qui
a été identifié au niveau des lymphocytes T mais on le trouve dans la plupart des cellules. Le
complexe β caténine/TCF se lie au promoteur de gènes impliqués dans prolifération cellulaire
et les stimuler.
-Que fait que la β caténine stimule ou non la prolifération et comment est ce régulé ? Soit la β
caténine est mobilisé dans les jonctions d’adhérence soit elle est dégradé s’il y a un excès.
Dans sa dégradation entre en compte APC qui forme un complexe avec β caténine, l’axine et

3
la GSK (glycogène synthase kinase) qui a un rôle dans la synthèse du glycogène à partir du
glucose mais aussi dans cette dégradation. La β caténine pour être dégradé doit être
phosphorylé par cette GSK. Pour être phosphoryler la β caténine doit être recruté par APC et
l’axine.
-APC ne permet pas la dégradation de l’ α caténine.
-DSH peut inhiber l’activité de la GSK. DSH vient de la drosophile et induit des
modifications phénotypiques sur la drosophile. DSH inhibe donc la dégradation de la β
caténine.
-DSH est recruté par un récepteur Frz à 7 domaines transmembranaires qui n’est pas couplé à
des protéines G hétérotrimériques. Frz reconnaît des ligants circulants de la famille Wg ou
Wnt qui existent chez l’homme. Quand on active Frz on augmente les taux de β caténine
intracellulaire libre qui va pouvoir interagir avec TCF et stimuler la prolifération.
-Quand perte de fonction d’APC on perd la dégradation de la β caténine donc stimulus
permanent de la prolifération.
-APC est un antioncogène : quand perte de fonction de protéine impliquée dans inhibition de
prolifération les cellules prolifèrent. La mutation d’APC entraîne d’abord une polypose
adénomateuse du colon bénigne donc les cellules se divisent rapidement alors il y a un risque
d’erreur de copie d’ADN donc risque de cancérisation. Si personne de la famille a eu un
cancer du colon suite à un polype il faut voir s’il y a mutation d’APC, dans ce cas ça serait
une forme familiale.
-la γ caténine peut :
-former des complexes avec TCF mais ces dimères ont une moindre affinité pour le
promoteur de gènes proliférant.
-entrer en compétition avec la β caténine pour former les jonctions d’adhérences.
-entrer en compétition pour la dégradation de la β caténine.
-si plakoglobine augmenté en concentration, suite à la compétition elle va augmenté le
taux de β caténine libre donc favoriser une prolifération cellulaire.
-cette plakoglobine peut aussi entrer en compétition pour la liaison au TCF mais c’est
moins important donc en général plus il y a de plakoglobine plus il y a de β caténine et
donc de prolifération.
-Mécanismes de régulation de la β caténine libre :
-expression de la plakoglobine.
-le récepteur frz et dsh qui régulent la dégradation.
-le nombre de complexe cadhérine/caténine : si augmentation de l’expression de
cadhérine ça immobilise plus de β caténine. Si jonctions d’adhérences rompu : libération de β
caténine donc augmente la prolifération.
-La phosphorylation et déphosphorylation de tyrosines jouent un rôle au niveau de
l’adhérence impliquant les cadhérines : la cadhérine peut être phosphorylé sur un tyrosine en
intracellulaire, la β caténine aussi. Cette phosphorylation déstabilise l’adhérence car diminue
l’affinité de la β ou γ caténine pour la cadhérine et cela diminue l’affinité des cadhérines pour
les cadhérines des cellules voisines. Il y a des tyrosines kinases qui phosphoryle
spécifiquement les cadhérines et caténines et il y a existe une tyrosine phosphatase qui peut
déphosphorylé : c’est la PTPμ qui favorise la formation des jonctions d’adhérence.
-Dans les desmosomes c’est la même structure avec des molécules homologues.
Tyrosine phosphatase : adhérence inter cellulaire
-Déphosphoryle spécifiquement les tyrosines.
-Membranaire ou cytosolique.

4
-Membranaire : au niveau du domaine extracellulaire elles adhèrent soit à d’autres TP soit à
d’autres molécules d’adhérences donc rôle dans adhérence intercellulaire et dans la
transmission de signaux provenant de l’extérieur vers l’intérieur de la cellule.
-Rôle :
-interaction avec les Ig (N-CAM), avec d’autres TP (CD45 qui fait partit du complexe
des récepteurs lymphocytaires), avec des protéines de la MEC.
-PTPμ régule la fonction de l’adhérence des cadhérines et des caténines.
-Structure : Il y a des motifs type fibronectine 3 et des motifs d’Ig. Tous ces motifs très
adhésifs (Fn et Ig) sont retrouvés au niveau de différentes molécules d’adhérence cellulaire.
En intracellulaire elles ont 2 domaines tyrosines phosphatases.
Molécules d’adhérence de la matrice extracellulaire
-La plupart sont de la famille des intégrines.
-Ce sont les récepteurs de la MEC.
-Protéines de la MEC :
-collagènes (12, col 3 dans le cartilage),
-laminine (principal protéine de lame basale),
-fibronectine (dans tout tissu conjonctif),
-vitronectine (idem),
-fibrinogène (de la MEC circulante = dans le sang) qui se polymérise pour former la
fibrine qui est la trame dans laquelle se piègent les plaquettes + globules blanc pour former le
thrombus,
-trombospondine (+++ au niveau des vaisseaux, rôle dans l’angiogénèse).
-Intégrines sont des hétérodimères : α et β avec chacune un domaine transmembranaire, un
petit intracellulaire et un grand extracellulaire.
-14 types de sous unités α (ne lie pas MEC) qui ont un rôle régulateur sur l’affinité des sous
unités β qui lient les protéines de la MEC.
-20 types différents de combinaison entre α / β qui conduisent à une spécificité des intégrines
dont certaines sont spécifique d’un type de protéine ou d’autres lient différentes protéines.
-Classification : Des β interagissent spécifiquement avec un seul type d’ α et ces
combinaisons sont spécifiques car β 5 α v reconnaît que la vitronectine alors que β 6 α v ne
reconnaît que la fibronectine. β 1 peut interagir avec différentes α.
-Les sites de liaisons = épitopes au niveau des protéines de la MEC qui sont reconnu par les
intégrines.
-Epitope formé de quelques AA (3 à 6) : le 1er identifié est le RGD (arginine, glycine, acide
aspartique) au niveau de la fibronectine.
-Ces épitopes doivent être exposés pour être lier par l’intégrine : exemple si le site de liaison
des fibrinogènes était reconnu par les intégrines des plaquettes il y aurait une coagulation
partout dans la circulation. Cela arrive dans la coagulation intravasculaire disséminé : grave
quand activation de facteurs de coagulation qui entraînent la polymérisation du fibrinogène
qui forme la fibrine et ces sites de reconnaissances par les intégrines sont exposés donc les
plaquettes s’y fixent. Grave, mortel car les tissus ne sont plus oxygénés et cela entraîne
consommation de tous les facteurs de coagulation donc en même temps une coagulation
disséminée partout dans l’organisme + des hémorragies partout.
-Organisation : β se lie aux protéines de la MEC et l’affinité est régulé par α. En
intracellulaire les intégrines interagissent avec des protéines qui les ancre aux filaments
d’actine donc rôle de l’adhérence cellulaire sur l’organisation du cytosquelette ce qui est
important pour la transmission de message.

5
-Structure des intégrines : Importance des 3 sites de calcium sur la sous unité α pour la
structure 3D ; présence de ponts dissulfure important pour maintient structure 3D ; présence
de domaine fibronectine.
-RGD au niveau de la protéine de MEC, lorsque cet épitope est exposé il est reconnu par le
site de liaison de β.
La fibronectine
-Protéine globulaire : beaucoup d’épitope sont masqués. RGD est un des domaines faisant
protrusion en dehors de la protéine donc peut être reconnu par intégrines.
-Beaucoup de domaines répétés :
-de type fibronectine 3.
-domaines fibrines = domaines de liaison de la fibrine donc ces protéines de la MEC
peuvent interagir entre elles. C’est important pour former le maillage auquel s’ancre les
cellules. C’est important lorsqu’il y a lésion au niveau d’un vaisseau qui est bouché par un
thrombus qui ne doit pas aller se balader car peut aller boucher un vaisseau plus étroit. Pour
que le thrombus puisse adhérer il faut des interactions de molécules au niveau du tissu
conjonctif de la média des artères ou du tissu conjonctif qui entoure les capillaires dans lequel
il y a beaucoup de fibronectine donc la fibrine peut se lier à la fibronectine donc contribuer à
ancrer le thrombus au niveau de la lésion vasculaire.
-domaines de liaison cellulaire : RGD par l’intégrine, Ig ou certaines Tyrosine
phosphatase.
-l’héparine et le sulfate de chondroitine (PG) qui peuvent se lier donc ça montre
comment l’héparine peut se fixer à la MEC donc empêcher la liaison de molécules
d’adhérences aux protéines de la MEC.
-Un site de liaison du collagène.
-Site de liaison de la gélatine = collagène chauffé dénature, n’existe pas dans
l’organisme.
-Site de liaison pour la fibrine.
-Site de crosslinking = formation de liaison covalente irréversible donc les
fibronectines peuvent se lier entre elles donc former le filet.
-Site de liaison des staphylocoques dorés = bactéries sur la peau +++. Sont à l’origine
des furoncles ou plus grave si pénètrent dans l’organisme. Se fixent sur la fibronectine donc
forment des absaits, des furoncles.
Régulation de la fonction des intégrines
-régulation de leur affinité : la stimulation d’une cellule peut modifier l’affinité des intégrines.
Quand il y a phosphorylation par PKC il y a augmentation de l’affinité des intégrines.
L’augmentation de l’affinité est transitoire car il y a des phosphatases c’est ce qui se passe
dans l’interaction entre leucocytes et cellules endothéliales donc ça permet aux cellules de
rouler le long de la paroi vasculaire.
-régulation de leur nombre : pour que les cellules se fixent bien il faut une augmentation de
l’expression des intégrines au niveau de la membrane plasmique.
-Suite à ces deux étapes il y a adhérence stable des cellules à la MEC.
-Résumé de ce qui détermine la liaison intégrine/ligant :
-l’affinité de l’intégrine (α qui influence β)
-la densité des intégrines au niveau de la membrane.
-la conformation du ligant donc l’exposition de l’épitope reconnu par les intégrines.
 6
6
1
/
6
100%