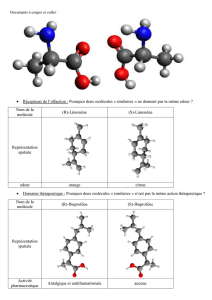
efficacité d`un médicament

P3 : La chimie du vivant et pour le vivant Activité documentaire n°4
C4 : Structure et propriétés d'une molécule
EFFICACITÉ D'UN MÉDICAMENT
Capacité(s) contextualisée(s) mise(s) en jeu durant l'activité :
✔!"#$%&$'('#('")*+&#'$(,'-(&./+$0%#&+.-(-1$(2
◦*'-()$+)$&3#3-(4&+*+5&61'(,'-(-#3$3+&-+07$'-8
◦*'-(9+./+$0%#&+.-(,'(0+*391*'-(4&+*+5&61'-8
)+1$(0'##$'('.(3:&,'.9'(*;&0)+$#%.9'(,'(*%(-#3$3+&-+03$&'(,%.-(*%(.%#1$'<
But
•=39+1:$&$(*'()%$%07#$'(&0)+$#%.#(61&(9+./7$'(>(1.'(0+*391*'(-'-()$+)$&3#3-(4&+*+5&61'-<
Documents (((((((s'approprier)
Doc.1 : La reconnaissance chirale et l'action biologique d'un médicament
?%(9@&$%*('-#(1.'()$+)$&3#3(&.@3$'.#'(>(#+1-(*'-(-A-#70'-(4&+*+5&61'-('#()'1#('")*&61'$(*'-
,&//3$'.#-()@3.+07.'-(+4-'$:3-(%1(.&:'%1(,'(*'1$(%9#&:<
!.( '//'#8( 3#%.#( ,+..3( 61'( *'-( %9&,'-( %0&.3-8( 4$&61'-( 3*30'.#%&$'-( ,'-( )$+#3&.'-( 61&
9+.-#'.#( *'-( $39')#'1$-( 4&+*+5&61'-8( -+.#( ,'-( 0+*391*'-( 9@&$%*'-8( -'1*'-( ,'-( 0+*391*'-
%A%.#( 1.'( 53+03#$&'( )%$#&91*&7$'( '#( ,+.9( 9@&$%*'-( )'1:'.#( &.#'$%5&$( %:'9( 9'-( $39')#'1$-(2( +.
)%$*'(%*+$-(,'($'9+..%&--%.9'(9@&$%*'<
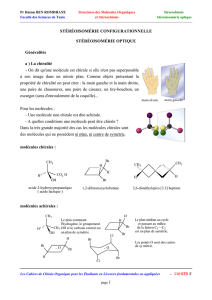
B'( 9+.9')#( ,' reconnaissance chirale(&.,&61'(61'(*'-( ,'1"(3.%.#&+07$'-(+.#(,'-(%//&.-
,&//3$'.#'-()+1$(1.(0C0'($39')#'1$(D+1('.EA0'F<(B'##'(%//&.('-#(4%-3'(-1$(1.(0&.&010(,'
#$+&-(-&#'-(,G&.#'$%9#&+.('.#$'(*'(-+*1#3('#(*'($39')#'1$<(?'($39')#'1$(-'$%(9%)%4*'(,'(,&//3$'.9&'$
*'-( ,'1"( 3.%.#&+07$'-( 9%$( 1.( -'1*( 3.%.#&+07$'( %1$%( 1.'( 9+0)*30'.#%$( -%#&-/%&-%.#'( '#
-'$%( *G3.%.#&+07$'( %9#&/( %))'*3( '1#+07$'<( ?G%1#$'( 3.%.#&+07$'( &.%9#&/8( 61&( .'( )'1#( &.#'$%5&$
61G%:'9(1.(+1(,'1"(5$+1)'0'.#-(,1($39')#'1$8('-#(%))'*3(,&-#+07$'(DFig.1F<
Fig.1 : Modèle de reconnaissance chirale
sciences physiques et chimiques - Terminale S
http://cedric.despax.free.fr/physique.chimie/

P3 : La chimie du vivant et pour le vivant Activité documentaire n°4
C4 : Structure et propriétés d'une molécule
?'-( ,'1"( 3.%.#&+07$'-( ,;1.( 03,&9%0'.#( 9@&$%*( )'1:'.#( %:+&$( ,'-( )$+)$&3#3-
)@%$0%9+,A.%0&61'-( '#( )@%$0%9+9&.3#&61'-( /+$#( ,&//3$'.#'-( ?%( $'9@'$9@'( '#( *'
,3:'*+))'0'.#( ,'( 03,&9%0'.#-( 9@&$%1"( )+-'.#( ,+.9( ,'-( )$+4*70'-<( H&.-&8( ,&:'$-'-
&.#'$%9#&+.-( ,'( .%#1$'( )@%$0%9+9&.3#&61'( )'1:'.#( &0)*&61'$( ,'-( 3.%.#&+07$'-8( *+$-61'( )%$
'"'0)*'(*;1.(&.@&4'(*'(03#%4+*&-0'(,'(*;%1#$'('#(0+,&/&'(-'-('//'#-<(I*(%$$&:'(%1--&(61;1.'(#&'$9'
-14-#%.9'(&.@&4'(-#3$3+-3*'9#&:'0'.#(*'(03#%4+*&-0'(,;1.(,'-(3.%.#&+07$'-<
Doc.2 : La thalidomide
?%(#@%*&,+0&,'( '-#(1.()@#%*&0&,+J5*1#%$&0&,'<(B;'-#( 1.( 03,&9%0'.#( -3,%#&/('#(@A).+#&61'<(K.
'//'#(#3$%#+57.'(9%#%-#$+)@&61'(-1$(*'(,3:'*+))'0'.#(/L#%*(%(3#3(+4-'$:3(,%.-(*'-(%..3'-(MN
)$+:+61%.#( ,'-( ,3/+$0%#&+.-( ,'-( 0'04$'-( D%03*&'8( )@+9+03*&'F( &.,1&#( )%$( *%( 9%)%9( ,1
03,&9%0'.#( >( &.@&4'$( *;%.5&+53.7-'( '.( &.#'$/3$%.#( %:'9( *'( ,3:'*+))'0'.#( ,'-( :%&--'%1"
-%.51&.-(,1(/L#1-<(?%(0+*391*'(%(1.('//'#(,;&.#'$9%*%#&+.(,%.-(*'-(0+*391*'-(,;H=O<(
?%(#@%*&,+0&,'('"&-#'(-+1-(,'1"(/+$0'-(3.%.#&+07$'-(DFig.2F8(/+$0'-(P('#(Q8(.;%A%.#()%-(*'-
0C0'-('//'#-<(?%(/+$0'(P()$+#75'(9+.#$'(*'-(.%1-3'-('#(&.@&4'(*%()$+,19#&+.(,'(ROST(D9'(61&
%( )+1$( 9+.-361'.9'( -+.( '//&9%9( ,%.-( *'( #$%&#'0'.#( ,'( 9'$#%&.'-( #10'1$-( +1( -A.,$+0'
&./*%00%#+&$'F8(*;%1#$'(%(,'-('//'#-(#3$%#+57.'-<
U%*@'1$'1-'0'.#8( *'-( ,'1"( /+$0'-( )+1:%.#( -'( 9+.:'$#&$( *;1.'( '.( *;%1#$'( &.( :&:+8( *;'//'#
#3$%#+57.'(.;%1$%&#()%-(3#3(3:('.(.;%,0&.&-#$%.#(61;1.'(/+$0'<
Fig.2 : Structure des énantiomères de la thalidomide
sciences physiques et chimiques - Terminale S
http://cedric.despax.free.fr/physique.chimie/

P3 : La chimie du vivant et pour le vivant Activité documentaire n°4
C4 : Structure et propriétés d'une molécule
Doc.3 : La cétirizine
?%(93#&$&E&.'(DFig.3F('-#(1.(%.#&@&-#%0&.&61'(1#&*&-3(,%.-(*'(#$%&#'0'.#(,'(*;%**'$5&'(,1($@10'(,'-
/+&.-<
?%(93#$&E&.'('-#(1.'(0+*391*'(9@&$%*'(V(-'1*'(*%(*3:+93#&$&E&.'(%(1.(&.#3$C#(#@3$%)'1#&61'<
Fig.3 : Structure des énantiomères de la cétirizine
Doc.4 : L'ibuprofène
?G&41)$+/7.'( )+--7,'( 1.( -'1*( 9%$4+.'( %-A03#$&61'( '#( )'1#( ,7-( *+$-( '"&-#'$( -+1-( /+$0'( ,'
,'1"( 3.%.#&+07$'-( DFig.4)<( ?'( )$+,1&#( 9+00'$9&%*( '-#( 53.3$%*'0'.#( *'( 03*%.5'( $%930&61'<
B')'.,%.#8(-'1*(*G3.%.#&+07$'(Q('-#(4&+*+5&61'0'.#(%9#&/('#()$3-'.#'(*'-('//'#-(#@3$%)'1#&61'-
,3-&$3-<( ?G3.%.#&+07$'( P('-#( #$7-( ,&//&9&*'( >( -3)%$'$( ,1( Q8( 0%&-( '-#( @'1$'1-'0'.#( &.+//'.-&/<
?G3.%.#&+07$'(Q(-'1*(9+00'.9'(>()$+,1&$'(-+.('//'#(%)$7-(WX(0&.1#'-8(%*+$-(61'(*'(03*%.5'
$%930&61'( .G'-#( %9#&/( 61G%)$7-( YZ( 0&.<( R$7-( 91$&'1-'0'.#8( *'( 9+$)-( @10%&.( )+--7,'( )%$
9@%.9'( *%( )$+)$&3#3( ,'( )+1:+&$( #$%.-/+$0'$( 9@&0&61'0'.#( *G3.%.#&+07$'( P( &.%9#&/( '.
3.%.#&+07$'(Q<
sciences physiques et chimiques - Terminale S
http://cedric.despax.free.fr/physique.chimie/

P3 : La chimie du vivant et pour le vivant Activité documentaire n°4
C4 : Structure et propriétés d'une molécule
Fig.4 : Structure des énantiomères de l'ibuprofène
Q+1$9'-(2([&\&)3,&%
@##)2]]@%*<%$9@&:'-J+1:'$#'-</$],+9-]NN]^^]W_]Z_]`=S]Ra!Q!bUKQRH`aHbcHa!P<),/
Quelques questions :
W< d1'**'(-#$19#1$'()%$#&91*&7$'(,+&#()+--3,'$(*%(0+*391*'(,1()$&.9&)'(%9#&/(,;1.(03,&9%0'.#
)+1$(%:+&$(*;%9#&+.(-+1@%'(e(`+1$61+&(e
X< d1'*-(-+.#(*'-(&.9+.:3.&'.#-(%1(.&:'%1()@%$0%9'1#&61'(e
Y< B+0)%$'$( '#( 9+00'.#'$( *%( 0%--'( ,'( )$&.9&)'( %9#&/( &.,&613'( -1$( *'-( ,'1"( 4+&#'-( ,'
03,&9%0'.#<
f< H(61+&('-#(,1'(*%(9@&$%*(,;1.'(0+*391*'(e
^< P')3$'$( 9'-( %#+0'-( '.( 61'-#&+.-( -1$( *'-( ,&//3$'.#'-( 0+*391*'-( )$+)+-3'-
)$393,'00'.#<
Conclusion :(((((((((analyser, valider, communiquer)
H(*;%&,'(,'-(,+910'.#-()$393,'.#-8($3,&5'$(1.'(-A.#@7-'(%$510'.#3'(0+.#$%.#(61'(*%(-#$19#1$'
,;1.(03,&9%0'.#(D)$&.9&)'(%9#&/F('-#(&0)+$#%.#'()+1$(-+.('//&9%9<
Pour les plus curieux...
Origine de la vie : l'énigme de la chiralité sous la lumière de
l'instrument Soleil
http://www.futura-sciences.com/fr/news/t/chimie-1/d/origine-de-la-vie-lenigme-de-la-chiralite-
sous-la-lumiere-de-linstrument-soleil_27127/
sciences physiques et chimiques - Terminale S
http://cedric.despax.free.fr/physique.chimie/
1
/
4
100%