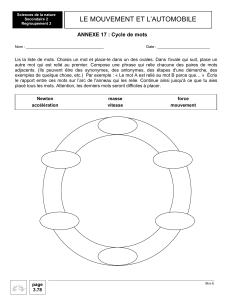
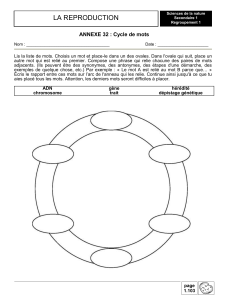
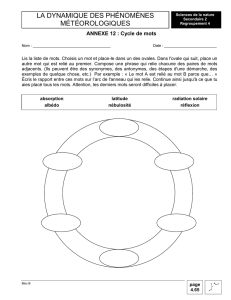
Rapport(s)

CÉR – Version 18 mars 2015
COMITÉ D'ÉTHIQUE DE LA RECHERCHE
RÉACTION(S) INDÉSIRABLE(S)/INCIDENT(S)
DÉFAVORABLE(S)
Monocentrique Multicentrique
NOM DU CHERCHEUR PRINCIPAL:
COURRIEL DU CHERCHEUR PRINCIPAL :
NOM DE L'INFIRMIER OU COORDONNATEUR :
NOM DE L’ÉTABLISSEMENT DU CHERCHEUR :
NUMÉRO ET TITRE DE L'ÉTUDE:
NO. RÉFÉRENCE CÉR :
1er RAPPORT 2e RAPPORT
No: No:
Effet: Effet:
Rapport initial Rapport initial
1er suivi 1er suivi
2e suivi 2e suivi
Autres: Autres:
Selon l'investigateur d'HMR: Selon l'investigateur d'HMR:
Relié Relié
Probablement relié Probablement relié
Possiblement relié Possiblement relié
Peu probable Peu probable
Non relié Non relié
Autre: Autre:
Selon cie: Selon cie:
Relié Relié
Probablement relié Probablement relié
Possiblement relié Possiblement relié
Peu probable Peu probable
Non relié Non relié
Ne se prononce pas Ne se prononce pas
Autre: Autre:

CÉR – Version 18 mars 2015
Tableaux des effets indésirables ci-joints (seulement si plus de 10 rapports en dehors d'HMR)
Commentaire (s'il y a lieu):
Autres (préciser) :
Nécessite une(des) modification(s) au formulaire d’information et de consentement:
Oui (joindre le(s) formulaire(s) de consentement modifié(s) Non
1er Général français (version/date): Anglais:
2e Général français (version/date): Anglais:
1er Génétique français (version/date): Anglais:
2e Génétique français (version/date): Anglais:
Autre(s) français (version/date): Anglais:
Précisez:
Coordonnées de facturation :
SIGNATURE CHERCHEUR: _________________________ DATE: ______________
* Chaque item coché doit être accompagné du document explicatif
** Le masculin, singulier est employé afin d’alléger le texte
1
/
2
100%