Etude d`une transformation chimique lente : réaction entre les ions

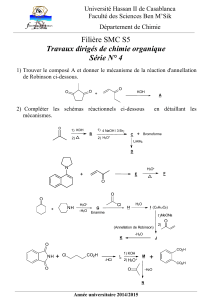
Page 1 sur 6
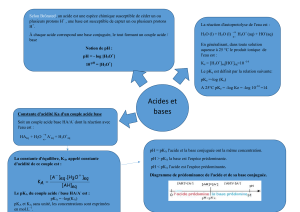
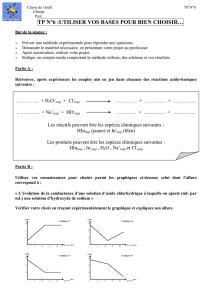
Suivi d’une transformation chimique Document : I.Akdime – N.Chevalier
TS
Chimie
Suivi d’une transformation chimique
Sujet de
synthèse
- Sujet -
Trois binômes de TP d’une classe de terminale S souhaitent réaliser le suivi cinétique de la
réaction, supposée totale, entre l'acide chlorhydrique et le magnésium.
L’équation chimique associée à cette transformation est : Mg(s) + 2 H3O+(aq) = H2 (g) + Mg2+(aq) + 2
H2O.
Leur professeur les laisse choisir librement la méthode de suivi, en leur demandant de justifier
leur choix. Il leur impose, à tous, les contraintes suivantes :
Faire réagir un volume V0 = 300 mL d'acide chlorhydrique (H3O+(aq) + Cl-(aq)) de concentration
en soluté apporté c0 = 2,0 x 10-2 mol.L-1 avec un ruban de magnésium de longueur L = 4,8 cm.
On supposera que le volume de la solution reste constant quel que soit la méthode de suivi
envisagée.
Travailler à une température T= 293 K, la pression atmosphérique étant P0 = 1,009 x 105 Pa.
Il leur fournit par ailleurs, les données nécessaires :
- masse molaire du magnésium : M(Mg) = 24.3 g.mol-1
- masse linéique du ruban de magnésium : µ = 1,0 g.m-1
Chaque binôme, après mûre réflexion, choisit de suivre la réaction par une méthode physique
différente :
1 – Par suivi de l’évolution du pH du milieu réactionnel
2 - Par suivi de l’évolution de la pression dans un ballon dans lequel est enfermé le mélange
3 - Par suivi de l’évolution de la conductance du milieu réactionnel.
Rappels :
La conductivité d’une solution aqueuse exprimée en S.m-1, est : = (i [Xi]), où i représente
la conductivité molaire de l’ion Xi, de concentration dans la solution, [Xi].
La conductance G d’une solution aqueuse s’exprime par : G = k où k est la constante de cellule,
caractéristique du conductimètre utilisé.
Pour un gaz parfait, la quantité de matière n (en mole), la température T (en kelvin), la pression P
(en pascal) et le volume V (en mètre-cube) sont liés par l’équation des gaz parfaits : P.V = n.R.T
(avec R constante des gaz parfaits : R = 8,31 Pa.m3.mol-1.K-1).
Première partie : Etude préliminaire : bilan quantitatif de la transformation étudiée.
1- Calculez les quantités de matière introduites.
2- Complétez numériquement, sans justification, le tableau descriptif de l’évolution du système
donné en annexe.
L’avancement x sera choisi égal à la quantité de dihydrogène formé.

Page 2 sur 6
Suivi d’une transformation chimique Document : I.Akdime – N.Chevalier
Deuxième partie : suivi par pH métrie
Avant de commencer, le binôme ayant choisi le suivi par pH-métrie désire étudier la faisabilité de
l’expérience.
1- Comment évolue le pH de la solution au cours de la réaction ? Justifiez.
2- Calculez le pH initial, noté pH0.
3- a) En utilisant les résultats de la première partie, exprimez le pH mesuré, noté pHt, en
fonction de x(t), c0 et V0.
b) Calculez le pH attendu en fin de réaction, noté pH∞.
4- Les élèves ont à leur disposition un pH-mètre étalonné dont la précision est de 0,05 unité de
pH. Pensez vous que le suivi cinétique de cette transformation pourra être fait dans de
bonnes conditions ? Justifiez brièvement votre réponse.
Troisième partie : suivi par manométrie
Le deuxième binôme propose de suivre la transformation du système par manométrie. Pour
cela ils versent l’acide chlorhydrique dans un ballon de volume Vb = 500 mL. A la date t = 0, ils
introduisent le ruban de magnésium et bouchent rapidement le ballon avec un bouchon relié par
un tuyau de volume négligeable à un manomètre. Le ballon est maintenu dans un cristallisoir plein
d’eau à la température ambiante T = 293 K.
On fait l’hypothèse que les toutes les espèces gazeuses présentes dans le système chimique se
comportent comme des gaz parfaits. On note n(t), la quantité de matière des espèces gazeuses
présentes à la date t.
1- Comment évolue la pression dans le ballon au cours de la transformation ? Justifiez.
2- Pourquoi doit-on maintenir le ballon dans l’eau ?
3- Donnez l’expression de n(air), quantité de matière gazeuse présente initialement, en fonction
de P0, V0, Vb, R et T.
4- a) Donnez l’expression de n(t) en fonction de x(t), P0, V0, Vb, R et T.
b) Déduisez-en l’expression de la pression P(t) dans le ballon à une date t quelconque en
fonction des mêmes données.
5- En utilisant les résultats de la première partie, déterminez la pression finale dans le ballon,
notée P∞.
6- Les élèves ont à leur disposition un manomètre de laboratoire. La notice du manomètre
indique une gamme de mesures de 0 à 2,50 x 105 Pa . Pensez-vous que le suivi cinétique de
cette transformation pourra être fait dans de bonnes conditions ? Justifiez brièvement
votre réponse.
Quatrième partie : suivi par conductimétrie
Le troisième binôme propose de suivre la transformation du système par conductimétrie.
1- Sachant que (H3O+) > (Mg2+) > (Cl-), expliquez qualitativement comment évolue la
conductivité de la solution au cours de la réaction.
2- Exprimez la conductivité (t) de la solution à la date t en fonction de x(t) et des données.
3- Exprimer la conductivité en début et en fin de réaction, respectivement 0 et ∞.

Page 3 sur 6
Suivi d’une transformation chimique Document : I.Akdime – N.Chevalier
Cinquième partie : analyse des résultats expérimentaux
Après avoir exploité ses résultats, un binôme a obtenu le graphe t x(t) donné en annexe.
1- Définissez la vitesse volumique de la réaction v(t) à la date t.
2- Déterminez cette vitesse v à la date t = 200 s. Justifiez brièvement la méthode utilisée.
3- Déterminez le temps de demi-réaction t1/2.
- Annexe -
Première partie : Tableau d’avancement
Réactio
n
Mg(s) + 2 H3O+(aq) = H2(g) + Mg2+(aq) + 2 H2O
Date
Avancemen
t
(mmol)
Quantité de
Mg (mmol)
Quantité de
H3O+ (mmol)
Quantité de
H2 (mmol)
Quantité de
Mg2+ (mmol)
Quantité de
H2O (mmol)
t = 0
excès
t
excès
t
excès
Cinquième partie : Résultats expérimentaux : graphe x(t)
0
40
80
120
160
200
240
280
320
360
400
440
480
520
560
600
0
0,2
0,4
0,6
0,8
1
1,2
1,4
1,6
1,8
2
x(mmol)
t(s)

Page 4 sur 6
Suivi d’une transformation chimique Document : I.Akdime – N.Chevalier
- Corrigé -
Première partie
1- Quantité de magnésium introduit :
n(Mg)0 =
-2
xx -3
int roduit
0
m(Mg) µ.L 1,0 4,8 10
; A.N. : n(Mg) = 2,0 x 10 mol
M(Mg) M(Mg) 24,3
Quantité d’ions oxonium introduits :
La mise en solution du chlorure d’hydrogène impose : [H3O+(aq)] = c0.
Alors : n(H3O+(aq))0 = c0.V0 ; A.N. : n(H3O+(aq))0 = 2,0 x 10-2 3,00x10-1 = 6,0 x 10-3 mol
2-Les proportions stoechiométriques imposent : n(H3O+(aq))réagit = 2.n(Mg)réagit.
Or : n(H3O+(aq))0 > 2 n(Mg)0. Le magnésium est le réactif en défaut.
Réaction
Mg(s) + 2 H3O+(aq) = H2 (g) + Mg2+(aq) + 2 H2O
Date
Avancement
(mmol)
Quantité
(mmol)
Quantité
(mmol)
Quantité
(mmol)
Quantité
(mmol)
Quantité
(mmol)
t = 0
x = 0
2,0
6,0
0
0
excès
t
x
2,0 - x
6,0 – 2x
x
x
excès
t
xmax = 2,0
0
2,0
2,0
2,0
excès
Deuxième partie :
1- Les ions oxonium sont consommés lors de la réaction. Le volume du milieu réactionnel restant
constant, leur concentration diminue au cours du temps.
Par définition : pH = -log [H3O+(aq)]. La fonction log étant strictement croissante sur ]0 ; + ∞[, le
pH augmente.
2- Nous avons vu que [H3O+(aq)] = c0. Ainsi : pH0 = -log(c0) . A.N. : pH0 = -log(2,0 x 10-2) = 1,7
3- a) D’après le tableau d’avancement : n(H3O+(aq))t = n(H3O+(aq))0 – 2.x(t),
Soit [H3O+(aq)]t = [H3O+(aq)]0 – 2
0
x(t)
V
= c0 – 2
0
x(t)
V
Or : pHt = -log[H3O+(aq)]t. On obtient : pHt = -log
0
0
x(t)
c - 2 V
b) En fin de réaction, x(t∞) = xmax et pH∞ =
max
0
0
x
c - 2 V
;
A.N. : pH∞ = -log
max
0
0
x
c - 2 V
= 2,2
4- La précision des valeurs affichées par le pH-mètre impose des domaines de valeurs possibles :
pH0 Є [1,65 ; 1,75] et pH∞ Є [2,15 ; 2,25]. L’écart minimal entre les valeurs possibles n’est que de
0,4 unité pH, ce qui est très faible. Cet écart est insuffisant pour mener à bien un suivi pH-
métrique de cette réaction.

Page 5 sur 6
Suivi d’une transformation chimique Document : I.Akdime – N.Chevalier
Troisième partie
1- Au cours de la réaction, du dihydrogène est formé. L’air et le dihydrogène formé sont les
seules espèces gazeuses. La pression augmente dans le ballon.
2- La température est une variable d’état qui apparaît dans l’équation d’état des gaz parfaits. La
réaction est exothermique. Le fait de placer le ballon dans un bain à température constante
maintient le milieu réactionnel à température constante et permet de relier directement la
quantité de dihydrogène formé à la pression mesurée.
3- Le volume occupé par l’air initialement est égal à Vb – V0. L’air étant considéré comme un gaz
parfait, l’équation d’état à l’instant initial s’écrit :
P0 (Vb – V0) = n(air).R.T n(air) =
0 b 0
P (V V )
R.T
4- a) La quantité des espèces gazeuses est égale à la quantité initiale d’air plus, la quantité de
dihydrogène formé :
n(t) = n(air) + n(H2(formé)). Or d’après le tableau d’avancement : n(H2(formé))= x(t).
Avec l’expression établie précédemment, on obtient : n(t) =
0 b 0
P (V V )
R.T
+ x(t)
b) Toute la matière gazeuse est contenue dans le volume constant Vb –V0. L’équation d’état des
gaz présents à une date t s’écrit : P(t).(Vb – V0) = n(t).R.T. En introduisant l’expression
précédente, on obtient :
P(t) =
0 b 0
0
b 0 b 0
+ x(t
P (V V )
R.T R.T
P(t) P + x(t)
V V R.T V V
)
5- En fin de réaction, x(t∞) = xmax et P∞ = P0 + xmax
b0
R.T
VV
.
A.N. : P∞ = 1,009x105 + 2,0x10-3
5
3
8,31x293 1,25 x 10 Pa
(0,500 0,300)x10
6- Compte tenu de l’étendue de la gamme de mesures, l’amplitude de pression mesurée,
P∞-P0 = 0,24x105 Pa, permettra de mener à bien un suivi cinétique de cette transformation par
manométrie.
Quatrième partie
1- Au cours de la transformation, du point de vue de la conductivité, les ions oxonium sont
remplacés par les ions magnésium de conductivité molaire ionique inférieure. La conductivité
totale du milieu réactionnel diminue au cours de la transformation.
Rq1 : cela est d’autant plus vrai qu’il disparaît 2 ions oxonium quand il se forme un ion magnésium.
Rq2 : les ions chlorure étant des ions spectateurs, leur concentration reste constante : ils ne
sont pas à l’origine d’une variation de la conductivité totale de la solution.
2- Par définition : σ(t) = λ(H30+).[H3O+]t + λ(Mg2+).[Mg2+]t + λ(Cl-).[Cl-]0.
Les ions chlorure étant des ions spectateurs, [Cl-]0 = c0. D’autre part, à l’aide du tableau
d’avancement, on obtient finalement :
σ(t) = λ(H30+)
0
0
x(t)
c - 2 V
+ λ(Mg2+)
0
x(t)
V
+ λ(Cl-).c0
Soit : σ(t) =
0
x(t)
V
[ λ(Mg2+) - 2 λ(H30+)] + c0 [λ(H30+) + λ(Cl-)]
 6
6
1
/
6
100%