EXERCICE I : À PROPOS DU MARQUAGE ISOTOPIQUE (6,5 points)

840909114 Tle S 2008-2009
DEVOIR SURVEILLÉ N°3
CALCULATRICE INTERDITE
EXERCICE I : À PROPOS DU MARQUAGE ISOTOPIQUE ( 13 points)
Le marquage isotopique consiste à remplacer dans la molécule que l’on désire étudier, un atome ou un groupe d’atomes par un
atome radioactif de manière à pouvoir l’utiliser comme traceur.
En cancérologie, le traceur utilisé pour l’imagerie médicale est le glucose marqué par le fluor 18. Ce traceur s’accumule
préférentiellement dans les cellules cancéreuses, grandes consommatrices de sucre. Cette technique se singularise par
l’utilisation d’isotopes radioactifs dont le temps de demi-vie est beaucoup plus court que les produits classiques de la médecine
nucléaire. Ainsi le fluor 18 a un temps de demi-vie radioactive de 110 minutes. Pour cette raison le traceur est fabriqué sur place
de manière à ce qu’au moment de son injection au patient la dose administrée ait une activité de 260 MBq.
Le « fluor 18 » (
9
18F
) est un isotope radioactif du fluor. Il est produit sur place dans le laboratoire d’imagerie médicale. Le
« fluor18 » se désintègre spontanément pour donner l’isotope 18 de l’oxygène (
8
18O
).
Aides au calcul : les données suivantes peuvent être utiles dans l’ensemble de l’exercice :
ln 1 = 0
ln2 = 6,910-1
ln(102) = 4,6
1
ebeb
e1 = 2,7
e2 = 7,4
ln(10-2) = -4,6
4,6 3,6 = 17
4,6 / 3,6 = 1,3
3,6 / 4,6 = 0,78
1. Donner la composition du noyau de l’isotope 18 du fluor.
2. Ecrire l’équation de désintégration et préciser de quel type de radioactivité il s’agit.
Le laboratoire d’imagerie médicale est équipé d’un appareil qui permet de remplacer un groupement hydroxyle –OH du glucose
par un atome de « fluor 18 ». Le nombre N de noyaux radioactifs de « fluor 18 » encore présents varie en fonction du temps et
suit une loi de décroissance exponentielle.
3. Enoncer la loi de décroissance radioactive reliant N(t) et N0, nombre de noyaux au temps t = 0
4. Donner la définition de t1/2, temps de demi-vie radioactive.
5. Déterminer alors la relation entre t1/2 et
, constante radioactive.
6. Par une analyse dimensionnelle, déterminer l’unité de
dans le système international. À l’aide des données du texte
encadré et en justifiant, choisir parmi les nombres suivants, celui qui permet d’évaluer l’ordre de grandeur de
.
10–4 104 10–2 102
L’équipe du laboratoire d’imagerie médicale doit réaliser 2 examens dans la matinée sur deux patients différents. Deux doses de
traceur contenant le même nombre N0 de noyaux radioactifs sont fabriquées en même temps avant leur injection pour réaliser ces
examens. Au moment de son injection au patient la dose de traceur doit avoir une activité de 260 MBq. Lors du premier examen
on injectera la dose notée D1 à 9 h 00.
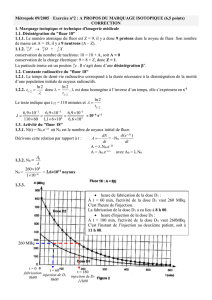
La mesure expérimentale de l’activité de chaque dose, toutes les vingt minutes, à partir de la date t = 0 min (instant de
fabrication), a permis de tracer le graphe A = f(t) représenté sur la figure ci-dessous :
On rappelle que :
A N
t
et 1MBq = 106 Bq
7. Donner l’expression de A(t) en fonction de t,
et A0,
puis en fonction de t,
et N0 et enfin en fonction de
et
N(t).
8. Calculer le nombre de noyaux de « fluor 18 »
présents dans la dose de traceur au moment de son
injection au patient lors d’un examen médical. On
donne
= 1
10–4 s-1
A (MBq)
Fluor 18 : A = f(t)
t (min)

840909114 Tle S 2008-2009
9. En vous aidant de la figure ci-dessus, déterminer l’heure de la fabrication de la dose de traceur notée D1. A quelle heure le
deuxième examen correspondant à l’injection de la dose notée D2 préparée en même temps que la dose D1 aura-t-il lieu ?
10. L’injection d’une dose a lieu à un instant de date t quelconque. Calculer l’ordre de grandeur, exprimé en heures, du temps
nécessaire après l’injection pour que l’activité soit 100 fois plus faible qu’au moment de l’injection.
EXERCICE II : EQUILIBRE D’UNE REACTION ( 7 points)
On s’intéresse ici à l’état d’équilibre atteint par la réaction qui a lieu entre l’acide benzoïque (utilisé comme conservateur dans
l’industrie) et l’eau.
Pour cela, on mesure la conductivité de solutions diluées d’acide benzoïque dans l’eau.
Mode opératoire
À l’aide de la solution S0 de concentration molaire apportée c0 = 1,0.10-2 mol.L-1 , on prépare des solutions diluées de
concentrations décroissantes :
5,010 –3 mol.L-1 ; 2,510 –3 mol.L-1 ; 2,010 –3 mol.L-1 ;
1,010 –3 mol.L-1 ; 6,710 –4 mol.L-1 ; 5,010 –4 mol.L-1.
On mesure la conductivité de la solution S0 et des solutions diluées en plongeant dans chaque solution la même cellule
de conductimétrie.
Le tableau ci-dessous donne les résultats des mesures :
c0
c1
c2
c3
c4
c5
c6
c
(en mol.L-1)
1,010–2
5,010–3
2,510–3
2,010–3
1,010–3
6,710–4
5,010–4
(en µS.cm-1)
273,4
189,0
132,0
115,0
81,3
61,7
52,1
On négligera la conductivité de l’eau distillée.
On donne pour le couple acide benzoïque / ion benzoate : C6H5CO2H(aq) / C6H5CO2-(aq)
On donne pour l’eau : H2O(l) / HO-(aq) et H3O+ / H2O(l)
On rappelle que 1 µS.cm-1 = 10-4 S.m-1
Aide au calcul :
81,331,0 = 2,52.103
81,3 / 31,0 = 2,62
27,3 31,0 = 8,46.102
27,3 / 31,0 = 8,81.10-1
Préciser pour chaque affirmation ci-dessous (en italique) si elle est VRAIE ou FAUSSE en justifiant votre raisonnement à
chaque fois. En particulier, si l’affirmation est FAUSSE, donner la version exacte.
A1. L’équation de la réaction entre l’acide benzoïque et l’eau est : C6H5CO2H(aq) + H2O(l) = C6H5CO2-(aq) + HO-(aq)
On considère un volume V de la solution d’acide benzoïque de concentration molaire apportée c.
A2. Le taux d’avancement final
de la transformation peut s’écrire :
H3O
f
c
On note « a » la constante telle que : a = C6H5CO2- + S.m2mol-1
A3. La relation entre la conductivité
et la concentration en ions H3O+ est :
H3O
f
a
A4. Le taux d’avancement final pour la solution de concentration c4 vaut 2,62.10-4 et est inférieur au taux d’avancement final de
la solution de concentration c0.
A5. Le quotient de réaction à l’équilibre s’exprime sous la forme :
Qr,eq
2
a2ca
---- FIN ----
1
/
2
100%