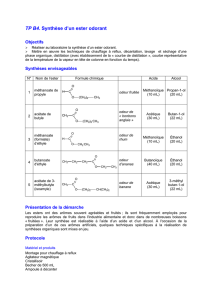
Synthèse d'un ester : TP Chimie Organique

Thème : Créer et reproduire des espèces chimiques
Compétences exigibles :
réaliser les opérations suivantes : chauffage à reflux, distillation, lavage d’une phase organique, séchage
d’une phase organique liquide.
appliquer des consignes de sécurité
justifier les opérations d’un protocole
calculer un rendement Introduction
Un arôme alimentaire est une espèce chimique qui renforce le goût des aliments et des boissons ; il peut
être naturel extrait par hydrodistillation des plantes ou artificiel. Il n’est pas repéré par un code
particulier sur les étiquettes. Des alcènes, des alcools, des aldéhydes, des cétones sont utilisés comme
arômes ; cependant les substances les plus utilisées sont des esters.
Le groupe caractéristique ester :
Les esters possèdent le groupe caractéristique suivant :
Un ester a pour formule générale : avec R = chaîne carbonée ou R = H
et R’ obligatoirement une chaîne carbonée
noté également R – COO – R’
Nomenclature : la première partie du nom de l’ester est construit à partir de l’acide R – COOH dont il
dérive. On remplace la terminaison oïque par oate.
la seconde partie du nom désigne le groupe alkyle R’
exemple : CH3 – COO – CH3 dérive de l’acide CH3 – COOH acide éthanoïque
– CH3 est un groupement méthyle
CH3 – COO – CH3 se nomme éthanoate de méthyle ( ou acétate de méthyle )
La réaction d’estérification : réaction entre un acide carboxylique et un alcool
Equation chimique : R – COOH + R’ – OH = R – COO – R’ + H2O
acide + alcool = ester + eau
les ions H+ catalysent cette réaction
rendement de la synthèse : =
f
max
n (ester) quantité d'ester obtenue
=
n (ester) quantité maximale d'ester attendue
remarques : - le calcul de nécessite la détermination du réactif limitant
- on peut aussi écrire =
f
max
x
x
TP B5 Synthèse d’un ester utilisé
comme arôme alimentaire
C
O
O
R
R'
C
O
O
C

I – Synthèse de l’éthanoate d’éthyle
L’éthanoate d’éthyle est un ester à odeur de pomme ; il est présent dans les
arômes artificiels de pomme, de cerise, de mûre, d’ananas …..
C’est un liquide qui bout à 77°C. On peut l’obtenir par réaction, en
présence d’ions H+, de l’acide éthanoïque avec l’éthanol.
ATTENTION la manipulation des acides concentrés ( acide éthanoïque pur et acide sulfurique
concentré ) nécessite l’utilisation des lunettes et des gants de protection
Dans un ballon bicol de 250 mL, introduire par l’ouverture latérale :
- à l’aide d’une pipette jaugée munie d’une propipette, 20,0 mL d’acide éthanoïque ( ou acide acétique )
- à l’aide d’une éprouvette graduée , 30 mL d’éthanol.
- A l’aide d’une pipette munie d’une propipette, 1 mL d’acide sulfurique concentré.
- Quelques grains de pierre ponce
voir le schéma du montage dans le compte rendu
Alimenter le réfrigérant en eau ( ATTENTION , ouvrir très progressivement le robinet ) et porter le
mélange à ébullition douce pendant 30 minutes.
Arrêter le chauffage et abaisser le chauffe ballon.
Retirer le ballon du montage et laisser refroidir le mélange réactionnel à l’air ambiant puis dans un bain
d’eau froide.
II – Extraction de l’ester
Verser ensuite le contenu du ballon dans une ampoule à décanter contenant environ 50 mL d’une solution
saturée de chlorure de sodium. ( remarque : retenir les grains de pierre ponce )
Agiter prudemment quelques instants ( en dégazant régulièrement ) puis éliminer la phase aqueuse.
Ajouter alors à la phase organique 60 mL d’une solution aqueuse d’hydrogénocarbonate de sodium ( Na+(aq)
+ HCO3-(aq) ) à 1 mol.L-1. Laisser dégazer jusqu’à la fin.
Laisser décanter puis éliminer la phase aqueuse.
Recueillir la phase organique dans un bécher. Sécher cette phase avec du chlorure de calcium anhydre ( ou
du sulfate de cuivre anhydre ) puis filtrer en recueillant le filtrat dans un erlenmeyer propre et sec.
Déterminer la masse d’ester obtenue.
III – Distillation fractionnée du produit obtenu
On pourrait vérifier que l’ester obtenu est le produit souhaité ( et même l’isoler s’il faisait partie d’un mélange
d’espèces organiques miscibles ) en effectuant une distillation fractionnée.
Pour cela, on pourrait utiliser le protocole suivant :
Prévoir un erlenmeyer préalablement pesé pour recueillir le distillat.
Verser le produit dans le ballon. Mettre quelques grains de pierre ponce et lancer le chauffage.
Observer la progression des vapeurs dans la colonne et l’évolution de la température en tête de colonne.
( Au cours de la distillation, relever les températures à intervalles de temps réguliers ). Poursuivre la distillation
tant que la température reste comprise entre 72°C et 77°C.
Remarque : ne pas chauffer le ballon à sec ( il se peut qu’il n’y ait que de l’ester souhaité dans le ballon ).
Déterminer la nouvelle masse d’ester obtenue.
On pourrait vérifier l’odeur de cet ester en le diluant 5 fois dans de l’éthanol.

IV – Compte rendu
Données :
- CO2,H2O/HCO3- : pKa = 6,4 ; CH3COOH /CH3COO-: pKa = 4,8 ;
- l'espèce CH3COOH est soluble à la fois dans la phase aqueuse et un peu dans la phase organique ;
- l'espèce CH3COO- n'est soluble que dans la phase aqueuse.
M en g.mol-1
Densité
Température de
fusion en °C
Température
d’ébullition en °C
Solubilité dans
l’eau
Acide
éthanoïque*
60
1,05
16,6
118
infinie
Ethanol
46
0,81
-117
78
infinie
Ethanoate
d’éthyle
88
0,89
-84
77
peu soluble**
* l’acide éthanoïque utilisé est à 80 % en masse
** les esters peu polaires sont peu solubles dans l’eau et quasiment insolubles dans l’eau très salée ( solution de
chlorure de sodium saturée )
A propos de la synthèse :
1) Compléter la légende du montage à reflux.
2) Ecrire l’équation de la réaction d'estérification.
3) Pourquoi réaliser l'expérience à chaud ?
4) Quel est le rôle de l’acide sulfurique concentré ?
5) A l'aide du tableau des données,
- calculer les masses et les quantités initiales de matière de chacun des réactifs.
- dire quel est le réactif en excès
- pourquoi introduit-on un réactif en excès et pourquoi avoir choisi celui-ci ?
6) Quelle est la masse théorique maximale d’ester que l’on peut obtenir ?
A propos de l’extraction :
7) En utilisant les données : - justifier la présence de deux phases ;
- justifier leur position dans l'ampoule à décanter ;
8) Quelle est la nature du gaz formé lors de l’ajout de la solution d’hydrogénocarbonate ? Justifier en écrivant
l’équation de la réaction Quel est le rôle de ce traitement ?
9) Que signifie sécher la phase organique avec du chlorure de calcium anhydre ou du sulfate de cuivre
anhydre. ?
10) Quel est l'aspect du produit brut ? Quels peuvent être les impuretés renfermées dans cette phase organique ?
A propos de la distillation :
11) Compléter la légende du montage à distiller.
12) Tracer l’allure de la courbe de distillation :
= f(temps) que l’on devrait obtenir.
13) Calculer le rendement de la synthèse. ( Préciser la masse d’ester obtenu avant distillation )

Montage à reflux
Montage à distiller

Matériel du TP
Pour la première séance
Montage à reflux
Pipette 20 mL et 1 mL
Propipette
Eprouvette 100 mL
Compte goutte
Bassine
Ampoule à décanter
Erlenmeyer
Gants
Lunettes
Spatule
Pour la seconde séance
Montage à distiller
Thermomètre à alcool
Pierre ponce
Acide éthanoïque à 80 %
Ethanol
Acide sulfurique concentré
Solution de chlorure de sodium saturée
Solution d’hydrogénocarbonate de sodium à
1 mol/L
Chlorure de calcium anhydre
1
/
5
100%