DEVOIR n°2

BCPST. 1- 851 et 852. Lundi 23/11/2009 .
DEVOIR n°2
Durée : 3h.
Le devoir comporte 2 exercices indépendants et obligatoires à traiter dans l'ordre de votre choix.
Il est impératif de consacrer autant de temps à chacun d'eux.
Merci de les traiter sur deux copies différentes, la copie relative au premier exercice traité sera relevée
au bout de 1h45.
EXERCICE 1.
Partie A. Déficience en une enzyme, l'hexokinase.
Des médecins étudient les conséquences d'une déficience en une enzyme, l'hexokinase, sur la
physiologie de patients atteints d'une maladie héréditaire.
1. Indiquer la réaction catalysée par cette enzyme .
2. Le principal produit de la réaction est un carrefour métabolique, départ de plusieurs voies
différentes dont la glycolyse (document 1).
Indiquer en quoi consiste, par rapport à la glycolyse, la voie menant à la synthèse de 2,3-
bisphosphoglycérate(2,3-BPG) représentée sur le document 2.
3. Pour étudier l'origine de la déficience en hexokinase chez ces patients, des biologistes effectuent
une purification de l'hexokinase de cellules d'un sujet normal et de cellules d'un sujet malade,
associée à un dosage de protéines. Les résultats sont dans le tableau 1.
Extrait cytoplasmique de
cellules de sujet normal
Extrait cytoplasmique de
cellules de sujet malade
Avant purification
30 mg de protéines
30 mg de protéines
Après purification (enzyme
pure
1,2 μg de protéines
1,2 μg de protéines
Tableau 1 : dosage de protéines.
3.1.Proposer une stratégie de purification de l'hexokinase.
3.2.Analyser les résultats consignés dans le tableau 1. Préciser ce que pourront en conclure les
médecins.

Document 1.
Document 2.
1,3- bisphosphoglycérate
COO-
mutase H-C-OPO32-
CH2OPO32-
phosphatase
3-phosphoglycérate
2- phosphoglycérate

4. Les médecins entreprennent ensuite une étude enzymatique sur les préparations purifiées
d'hexokinase. Le tableau 2 donne les vitesses initiales de la réacton enzymatique catalysée par
l'hexokinase pour différentes concentrations en substrat [S], dans le cas d'un sujet sain et d'un
sujet malade.
Le test enzymatique a été effectué dans 2 mL de volume réactionnel avec 100 μL de la solution
d'enzyme purifiée, diluée 10 fois.
[S] en mM
0,5
1
1,5
2
3
4
8
16
Sujet sain
Vo mM.mn-1
0,45
0,75
0,9
1,2
1,7
201
2,4
2,4
Sujet malade
Vo mM.mn-1
0,1
0,15
0,22
0,3
0,45
0,5
0,6
0,6
Tableau 2 : dosage enzymatique de l'hexokinase.
4.1.Donner la définition et la signification des paramètres Vmax et Km
4.2.Sans construire la courbe, déterminer les valeurs de Vmax et Km dans le cas d'une
hexokinase de sujet sain et de sujet malade.
4.3.Interpréter ces données.
4.4.Donner la définition de l'activité enzymatique d'une enzyme. Calculer l'activité
enzymatique de 1mL de la solution d'hexokinase, non diluée, du sujet malade (préciser
les étapes du calcul).
Partie B. L'hémoglobine.
5. Les acides aminés représentent les constituants de base des protéines. En utilisant comme
exemple l'hémoglobine, décrire rapidement les différents niveaux de structuration des protéines.
6. L'hémoglobine est un pigment oxyphorique qui fixe réversiblement le dioxygène et permet son
transport dans le sang. Le muscle contient une protéine, la myoglobine, dont la structure est
proche de celle d'un monomère d'hémoglobine.
6.1. Indiquer le mécanisme de fixation du dioxygène sur l'hémoglobine.
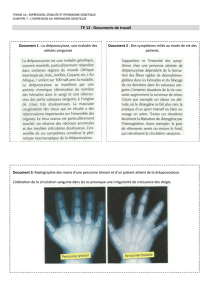
6.2. Interpréter les différences entre les courbes du document 3.
6.3. Envisager les différences fonctionnelles prévisibles à partir de ces courbes.
Document 3.

7. Préciser ce que représente la p50.
La valeur de p50 dépend de nombreux facteurs, en particulier du pH (effet Bohr).
Indiquer dans quel sens varie la p50 en fonction du pH et quelle en est la signification
fonctionnelle.
8. L'hémoglobine (Hb) purifiée a une affinité beaucoup plus grande pour le dioxygène que
l'hémoglobine dans le sang. Ceci a conduit Barcroft, en 1921, à supposer que le sang contient
une substance qui forme un complexe avec l'hémoglobine pour diminuer son affinité pour le
dioxygène. Cette substance a été identifiée en 1967 par Reinhold et Benesch comme étant le D-
2,3-bisphosphoglycérate (BPG), qui se lie préférentiellement à la désoxy Hb. L'affinité de Hb
pour le dioxygène est ainsi modulée par la concentration sanguine en BPG. Les courbes de
dissociation du complexe Hb-O2, dans des conditions correspondant à des valeurs
physiologiques à l'intérieur des globules rouges sont données dans le document 4.
La pO2 du sang artériel est de 13,3 kPa et celle du sang veineux est de 4kPa.
pO2 (kPa)
Document 4.
8.1. Préciser le rôle du BPG dans les échanges respiratoires sanguins.
8.2. Indiquer l'avantage physiologique constitué par la plus faible affinité pour le BPG de
l'hémoglobine foetale, alors que hémoglobines adulte et foetale pures ont la même affinité pour le
dioxygène.
8.3. Expliquer que la première manifestation de l'adaptation à l'altitude soit une augmentation de
la concentration en BPG. Celle-ci se produit en moins de 36 heures alors que l'augmentation du nombre
de globules rouges se fait sur une période de plus d'une semaine.
Partie C. Hémoglobine et hexokinase.
9. Sachant que la voie de synthèse du 2,3-BPG (partie A) a lieu uniquement dans les hématies,
préciser les conséquences physiologiques prévisibles d'une déficience en hexokinase.

EXERCICE N°2
La calséquestrine, une protéine qui représente plus de 7% des protéines totales du réticulum
sarcoplasmique mais qui semble absente du cytosol, a été isolée du muscle squelettique de lapin.
C’est une protéine de 44 000 Da (g/mol) capable de lier le calcium.
La constante de dissociation du calcium vis-à-vis de la calséquestrine est évaluée par la méthode
graphique de Hames-Woolf (voir la figure1). La calséquestrine saturée en calcium peut en effet
être isolée et l’on peut mesurer la vitesse initiale (V) de relargage du calcium au cours du temps
en présence de différents concentrations en calcium. L’équation de Hames –Woolf dérive de
l’équation de Lineweaver et Burk en multipliant les deux membres par la concentration en
substrat. L’équation de Lineweaver et Burk dérive elle-même de l’équation de Michaelis et
Menten :
V= VM.[S]/(KM+[s])
1. A partir de l’équation de Michaelis et Menten, déduisez l’équation de Hames-Woolf, et donnez
la valeur de la constante de dissociation (Kd), assimilée dans cette expérience à un KM, du
calcium vis-à-vis de la calséquestrine.
2. La courbe ci-dessous(figure 2 ) vous donne la capacité de liaison du calcium à la calséquestrine
en fonction du pH pour une concentration en calcium fixe et supérieure au Kd. Indiquez combien
de sites de fixation du calcium cette protéine comporte au pH intracellulaire physiologique ?
En ordonnée l’unité est exprimée en nmoles (10-9 moles) par mg de séquestrine.
3. Les constantes de dissociation habituellement trouvées en biologie sont de l’ordre de 10-6 à 10-7
M. Comparez ces valeurs à celle obtenue à la question 2 pour la calséquestrine. Que pouvez vous
en déduire quant à ces rôles biologiques dans le réticulum sarcoplasmique ?
1
2
 6
6
 7
7
 8
8
1
/
8
100%