Procréation

PROCREATION
Chapitre 1 : Du sexe génétique au sexe phénotypique
Introduction : La méiose et la fécondation sont apparues au cours de l’évolution en parallèle
de la reproduction sexuée et de la sexualité. L’alternance de ces deux mécanismes cellulaires
permet une grande variabilité des génomes. La méiose et la fécondation ne sont possibles que
si les organismes sont capables de produire des gamètes mâles ou femelles. Cela sous-entend
la présence d’appareils génitaux différents pour chacun des sexes.
Quels sont les phénomènes permettant la mise en place d’appareils génitaux fonctionnels
différents selon le sexe génétique ?
Bien que la reproduction sexuée soit apparue avec les premiers unicellulaires eucaryotes,
l’exemple traité se limitera aux Mammifères placentaires (présence d’un placenta pendant la
gestation et viviparité). Pour ce groupe les structures et fonctions des appareils sexuels mâle
et femelle sont acquises au cours de 4 étapes au cours du développement de l’individu.
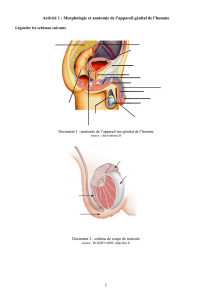
I. PREMIERE ETAPE : STADE PHENOTYPIQUE INDIFFERENCIE.
TP1 : Detsex
Même si le sexe de l'embryon est déterminé génétiquement dès la fécondation, la première
ébauche de gonade n'apparaît, dans l'espèce humaine, qu'à la cinquième semaine de
développement. Elle est formée à partir d’un lot de cellules embryonnaires qui donneront la
lignée germinale : les cellules germinales primordiales. Ces cellules forment une structure
particulière dans l’embryon : la crête génitale. A partir de cette crête, un appareil génital tout
d’abord indifférencié (même structure quel que soit le sexe génétique) se met en place. Ce
stade indifférencié perdure jusqu’à 7-8 semaines de développement.
Le stade indifférencié comporte :
- structures internes : deux gonades accolées aux reins embryonnaires, deux canaux de
Wolff (proches gonades), deux canaux de Müller, les quatre canaux sont reliés au
sinus uro-génital.
- structures externes : tubercule génital, sillon uro-génital, tubercule labio-scrotal.
L’apparence de l’appareil génital est le même quel que soit le sexe génétique
II. DEUXIEME ETAPE : DU SEXE GENETIQUE AU SEXE GONADIQUE.
A. Comparaison du sexe phénotypique et du caryotype.
Le caryotype XX conduit pour l’espèce humaine à la différenciation femelle de l’embryon et
le caryotype XY conduit à une différenciation mâle dans la grande majorité des cas. Il existe
cependant des anomalies qui ne respectent pas cette règle.
Caryotype
Maladie
Caractéristiques
Fréquence
XX
sujet femelle normal
Femelle fertile
XY
sujet mâle normal
Mâle fertile

XXY
syndrome de
Klinefelter
mâle stérile (testicules différenciés
mais réduits, absence de
spermatogonies, grande taille,
gynécomastie développement
excessif des seins chez
l’homme, virilisation incomplète)
1/700 hommes
XXYY,XXXY,XXXXY
ou mosaique XXX/XY
pseudo-Klinefelter
mâle stérile, syndrome apparenté au
Klinefelter
rare
XXX
triple X (les deux X
supplémentaires sont
inactivés)
femme fertile, gonades et phénotypes
normaux dans la majorité des cas
1/500 femmes
XYY
sujet mâle normal
mâle fertile, différenciation des
gonades et phénotype normaux
1/500 hommes
XO
syndrome de Turner
femme stérile (agénésie gonadique
(régression des ovaires après leur
différenciation), petite taille, ainsi
que problèmes de pigmentation,
rénaux, squelettique, auto-immuns,
variables selon les individus)
1/2700 femmes alors
que la probabilité est
de 1/500 (avortement
spontané dans 99%
des cas)
YO
Létal
l'absence de X est incompatible avec
le développement du zygote
XX
Homme XX
mâle stérile (testicules sans
spermatogonies)
1/20 000 naissances
XY
Femme XY
femme stérile (ovaires
dysgénésiques)
1/10 000 naissances
XX et XY (XX/XY)
Hermaphrodite vrai
stérile (tissu testiculaire et ovarien
dans les gonades)
1/30 000 naissances
Les anomalies de caryotype au niveau des autosomes conduisent généralement à une stérilité
de l’individu accompagnée d’une perturbation plus ou moins importante des caractères
sexuels secondaires et de la structure de l’appareil génital.
Chez certains individus (ci-dessus en grisé) le phénotype sexuel ne correspond pas aux
chromosomes sexuels, ces individus sont dits intersexués (présentent une inversion
sexuelle), et c'est l'étude de leurs chromosomes qui a permis en grande partie de déterminer
les gènes impliqués dans la détermination du sexe.
Comment peut-on expliquer ces phénotypes anormaux ?
Hypothèse : les phénotypes des individus présentant une inversion sexuelle sont dûs à la
présence sur le chromosome X d’un ou plusieurs gènes du chromosome Y et vice-versa. Ce
ou ces gènes serai(en)t responsables de la masculinisation ou de la féminisation de l’embryon.
B. Chromosome Y et masculinisation.
Autour de 7-8 semaines de développement, la différenciation de l’appareil génital
embryonnaire commence. Le premier évènement est la transformation de l’ébauche de gonade
en testicule (sexe génétique XY) ou en ovaire (sexe génétique XX).
Grâce aux individus présentant des inversions sexuelles, il a été possible d’identifier les gènes
responsables de cette différenciation.
Doc 3, 4 et 5 p273 : sonde moléculaire SRY
SRY : Sex determining Regiono Y chromosome = gène
TDF : Testicule determination factor : protéine.
La présence d’un seul gène de Y (résultat déduit de la transgenèse du doc 5), le gène SRY
suffit pour la masculinisation de l’embryon. La protéine qu’il fabrique, le facteur de
détermination testiculaire oriente la différenciation des cellules germinales primordiales en
spermatogonies. L’absence de ce gène conduit à la différenciation des cellules germinales
primordiales en ovogonies.

Comment le gène agit-il ?
C. SRY : un gène architecte.
Ce gène est situé sur le bras court du chromosome Y humain. La protéine produite à partir du
gène SRY possède un domaine, permettant sa liaison à l'ADN, nommé HMG. Ce domaine lui
permet d’agir sur des gènes d’une même famille appelé gènes SOX (SRY-related HMG-box)
qui interviennent dans de nombreux processus du développement.
Le domaine HMG permet au TDF de se fixer sur l’ADN et d’activer ou d’inactiver d’autres
gènes (c’est-à-dire de lancer ou stopper la production des protéines issus des gènes de la
famille SOX).
La chronologie de l'expression de SRY coïncide avec la période de détermination du sexe, il
s'exprime chez la souris de 10,5 à 12 jours post coïtum, spécifiquement dans les cellules
somatiques de la crête génitale mâle, ce qui correspond aux jours qui précèdent la
détermination testiculaire. On trouve des transcrits (ARNm) de ce gène dans le testicule
adulte murin et humain.
Des individus qui développent un phénotype femelle malgré la présence d'un Y (46,XY)
présentent une mutation dans le gène SRY, le rendant non fonctionnel.
Des individus XX développant un phénotype mâle sont porteurs de SRY sur le bras court
d’un des X.
La protéine (TDF) du gène SRY en agissant sur une cascade d’autres gènes conduit à la
masculinisation de l’embryon. Elle active notamment le gène SOX 9 dont le produit active le
gène et la production d’AMH dans les futures cellules de Sertoli.
SRY est donc responsable de l'établissement du sexe gonadique. Il est exprimé dans les
cellules somatiques de la crête génitale mâle (futures cellules du testicule). Il oriente la
différenciation des cellules germinales primordiales en spermatogonies.
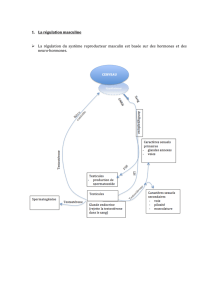
Bilan II. Ainsi le sexe génétique est déterminé à la fécondation, selon le chromosome
sexuel apporté par le spermatozoïde. L'établissement du sexe gonadique est sous
contrôle génétique et dépend de la présence du gène SRY. Suite à l'action du gène SRY,
une cascade d'autres gènes est activée dans le testicule. Tandis qu'en l'absence de SRY et
en présence de deux chromosomes X, la gonade se différencie en ovaire. Cette période de

différenciation gonadique se réalise chez l'homme entre la 5ème et 8ème semaine de
gestation.
Le gène SRY influence-t-il aussi la différenciation du reste de l’appareil reproducteur ?
III. 3EME ETAPE : DU SEXE GONADIQUE AU SEXE PHENOTYPIQUE DIFFERENCIE
Voir Detsex.
A. Expérience de castration.
1) Chez l’adulte
La castration chez l’adulte ne provoque pas de dédifférenciation de l’appareil génital. La
différenciation sexuelle est donc un processus définitif.
2) Chez l’embryon
La castration chez l’embryon mâle ou femelle conduite à la mise en place d’un appareil
génital femelle. La différenciation de l’appareil génital n’est donc pas sous contrôle génétique
mais sous le contrôle des gonades. La différenciation de l’appareil génital femelle se fait par
défaut, en absence de testicule.
Comment le testicule contrôle t-il le développement des autres organes ?
B. Expérience de greffe
1) Greffe d’un testicule
La greffe d’un testicule à un embryon castré, quel que soit le sexe génétique conduit à la
différenciation d’un appareil génital mâle. La présence d’un testicule greffé est donc
suffisante pour la masculinisation de l’embryon. Le contrôle du testicule sur la différenciation
se fait nécessairement par voie hormonale (libération d’une molécule véhiculée par le sang
jusqu’aux organes cibles) puisque la greffe n’interrompt pas cette propriété.
2) Greffe d’un ovaire
La greffe d’un ovaire conduit à la différenciation d’un appareil génital femelle. Etant donné
que c’est le même résultat après castration, on peut dire que la présence d’un testicule impose
la masculinisation de l’appareil génital et son absence conduit à une différenciation femelle
par défaut (qui se réalise même sans aucune gonade).
Quelles sont les hormones qui contrôlent ce développement ?
C. Expérience d’implant ou d’injection hormonale
Afin d’identifier les hormones responsables de la masculinisation de l’apapreil génital, on
réalise des implants de cristaux contenant des hormones ou bien des injections continues de
ces substances.
L’injection de testostérone chez un embryon castré mâle ou femelle conduit au maintien des
canaux de Wolff et de Müller.
L’injection d’AMH a un embryon castré mâle ou femelle conduit à la disparition des deux
types de canaux.
L’injection de l’AMH et de testostérone en continue à un embryon castré conduit à la
régression des canaux de Müller et au maintien des canaux de Wolff. Ces phénomènes
correspondent observés lors de la masculinisation de l’appareil génital indifférencié sous
l’influence des hormones produites par la gonade XY, le testicule.
Le testicule produit donc 2 hormones : l’AMH et la testostérone qui ont respectivement pour
cible les canaux de Müller et les canaux de Wolff. L’action de ces hormones conduit a la
différenciation d’un appareil génital mâle avec des testicules liés par les canaux de Wolff au
sinus uro-génital. L’AMH est produite par les cellules de Sertoli et la testostérone parles
cellules de Leydig.

L’absence de testicule et donc de ces hormones conduit au maintien des canaux de Müller et à
la régression spontanée des canaux de Wolff. Cela correspond à la différenciation femelle de
l’appareil génital où les ovaires sont liés au sinus uro-génital par les canaux de Müller.
L'établissement du sexe phénotypique mâle à la fin de la vie embryonnaire se réalise
sous l'effet des hormones sécrétées par les testicules ; l’absence de ces hormones conduit
à la différenciation d’un appareil génital femelle.
A la naissance, l’appareil génital n’est pas fonctionnel, quels sont les phénomènes qui
permettent sa maturation ?
IV. QUATRIEME ETAPE : LA PUBERTE, ACHEVEMENT DU PHENOTYPE SEXUEL.
A. Les transformations de la puberté.
Le passage de l'état d'enfant à celui d'adulte se caractérise par une série de transformations d'ordre
physique, sexuelles et psychoaffectives. La puberté correspond à la maturation des organes génitaux
(caractères sexuels primaires) et l'apparition de particularités spécifiques au sexe (caractères sexuels
secondaires). Ces transformations mettent plusieurs années à s'accomplir. L'âge du début des
modifications morphologiques et la vitesse de passage d'un stade de développement au suivant varient
beaucoup d'un enfant à l'autre. Cependant, une fois initiés, ces changements pubertaires
(développement des organes génitaux externes et des caractères sexuels secondaires) se réalisent selon
une séquence chronologique bien établie. Chez la fille, la puberté débute vers 10 ans. Elle est plus
tardive chez les garçons (12 ans). Les caractères touchés par ce phénomène sont les caractères sexuels
secondaires (caractères en dehors de l’appareil génital différents suivant le sexe) et la maturation de
l’appareil génital.
1) Chez la fille
L'ovaire, est, dès la naissance, un organe relativement mature. Dès la fin du 8e mois de gestation
l'ovogenèse est en effet terminée. La maturation des ovaires va conduire à la reprise de la méiose et à
la production d’un ovule fécondable tout les mois. Le premier signe de puberté est en général,
l'apparition des seins suivie 6 mois plus tard d'une pilosité sur les grandes lèvres, puis sur le pubis. La
pigmentation des mamelons apparaît un an plus tard. La pilosité axillaire se développe rapidement, en
général entre le moment du pic de croissance maximal et l'apparition des règles. L’apparition des
règles est un événement tardif de la puberté (âge moyen de 13 ans, plus ou moins 4 mois selon les
populations) mais n'en marque pas la fin. En effet, les premiers cycles menstruels sont anovulatoires et
il se passe environ 5 ans avant qu'un taux de fécondité normal soit atteint (vers 18 ans).
Stades de développement des seins (S1 à S5), et de la pilosité pubienne (PP1 à PP5),
en rapport avec l'âge chronologique, chez la fille
S1 < 9 ans
Pas de sein, petite élévation éventuelle du mamelon.
PP1 < 9 ans
Absence de poil, simple duvet.
S2 = 1011 ans
(limites usuelles entre 9 et 13.3 ans)
Apparition du bourgeon mammaire, surélévation du
mamelon par du tissu glandulaire.
PP2 = 1012 ans
(limites usuelles entre 9.6 et 14 ans)
Quelques poils épais, longs, clairsemés, sur les grandes
lèvres.
S3 = 1112 ans
Apparition de la pigmentation du mamelon et de
l'aréole, élargissement et saillie de l'aréole et de la
glande mammaire.
PP3 = 1112 ans
Poils plus fournis, bouclés, s'étendant au dessus de la
symphyse pubienne (Mont de Vénus).
S4 = 1213 ans
Projection de l'aréole et du mamelon en avant de la
glande mammaire.
PP4 = 1213 ans
Pilosité de type pratiquement adulte (triangle à base
horizontale), moins étendu.
S5 = 1415 ans
Sein adulte: retour de l'aréole dans le plan de la surface
du sein, sillon sous-mammaire distinct (stade 5 pas
toujours individualisé et régression du stade 5 au stade
4 parfois observée).
PP5 = 1314 ans
Pilosité pratiquement adulte, extension à la partie
interne des cuisses.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%