File

LE SANG
- 7,5% du poids corporel
- considéré comme tissu conjonctif, à cause de la similitude des deux tissus
- est composé par:
- la substance fondamentale - le plasma
- les cellules – les éléments figurés
- les fibres – la fibrine
Le plasma
- obtenu du sang après un traitement d’anti-coagulation (à l’aide d’un anti-coagulant),
suivi d’une centrifugation
- liquide jaunâtre, ayant une densité de 1027, formé par: 91-92% de l’eau, 7-8% de
substances organiques, 1-2% de substances inorganiques
Les éléments figurés
- sont produits continuellement dans la moelle osseuse hématogène
- des éléments cellulaires qui apparaissent au début dans des îlots hémato formateurs
extra – embryonnaires du mésenchyme du sac vitellin, puis dans le foie et dans la rate
et, finalement (chez l’adulte) dans la moelle hématogène; le processus est nommé
hématopoïèse
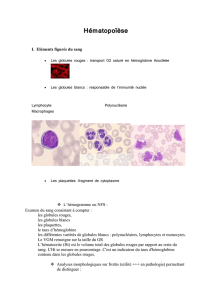
Les hématies
- dans les frottis, sont sphériques, à cause de l’étalement; couleur rouge/orange, à cause
de l’hémoglobine contenue
- forme de disque biconcave, aux bords arrondis, plus épais dans la périphérie 7 – 7,5
μm, plus mince dans la zone centrale 1,4-2 μm, surface – 140 μm2
- nombre: 4,5-5 millions/mm3 chez les hommes, 4/4,5 millions / mm3 chez les femmes
- ont la tendance d’adhérer réversiblement l’une à l’autre en vitro, en réalisant des
rouleaux
- durée moyenne de vie: 120 jours; après cet intervalle, elle perdent leur élasticité, en
étant retenues surtout dans la rate, ou elles sont phagocytées, le Fe étant réutilisé dans
l’érythropoïèse
La plasticité – la propriété des hématies de modifier leur forme grâce à la structure du
cytosquelette et à l’élasticité membranaire. Lorsque les hématies traversent les vaisseaux
capillaires, elles prennent la forme d’une coupe ; ensuite, elles reviennent à la forme initiale.
La membrane des hématies
- élastique
- une structure typique aux membranes cellulaires, contenant 40% lipides
(phospholipides, cholestérol, glycolipides), 50% protéines membranaires et 10%
hydrocarbures
- contient des récepteurs et glycoforine qui lui confèrent l’alloantigénicité
- les glycolipides et les glycoprotéines de la membrane contiennent des chaînes
hydrocarbonates aux déterminants antigéniques, constituant la base des systèmes des
groupes sanguins ABO et Rh
La structure
- sans organites, sans noyau
- cytosquelette
- des protéines qui, à côté de l’hémoglobine, maintiennent la forme des hématies, par un
processus actif, avec une consommation de ATP
- des filaments intermédiaires
- la spectrine, aux bouts de laquelle on trouve des structures nodales qui contiennent de
l’actine érythrocytaire, stabilisée par la tropomyosine

- l’ankirine – réalise la liaison avec la membrane plasmatique, phosphoprotéine de
couplage avec le domaine cytoplasmique de la protéine transmembranaire de bande 3
- les protéines de bande 4,1 et 4,9 stabilisent tout le réseau du cytosquelette
- à l’intérieur : 66-67% de l’eau, 33% de la globine couplée à une porphyrine (qui forme
la hémoglobine), des lipides, des enzymes de la glycolyse anaérobe, de la
hémoglobine - réductase et de l’anhydrase carbonique
- l’hémoglobine : chromoporphyrine (GM 68000 Da), en ayant la propriété de coupler
réversiblement le Fe et le maintenir bivalent : le processus est assuré par
l’hémoglobine - réductase, qui maintient le Fe en état réduit, en conférant la
réversibilité à la liaison de l’oxygène avec l’hémoglobine
- la globine / formée de 4 chaînes polypeptidiques, à chaque chaîne se couple (s’attache)
un groupe hem qui contient du Fe
- le hem – un pigment formé de 4 noyaux pyrroliques lies de 4 atomes de Fe réduit
La fonction principale
- de transporter l’oxygène, grâce à l’affinité de l’hémoglobine pour ce gaz
- au niveau des alvéoles pulmonaires, l’hémoglobine lie l’oxygène, lâche et réversible
au niveau du hem, sous la forme d’oxyhémoglobine
- dans les capillaires, au niveau des organes, grâce aux différences de pressions
partielles, l’hémoglobine va céder l’oxygène aux tissus
- l’hémoglobine a une affinité pour le CO, avec celui-ci elle forme un composant
stabile : la carboxyhémoglobine qui détermine l’hypoxie et, finalement, l’anoxie.
Les réticulocytes
- sont des hématies qui n’ont pas complété leur maturation ; ils deviennent des hématies
adultes en 2-3 jours
- diamètre 8-9
- représentent 0,8-1% des hématies périphériques
Les plaquettes
- sont des petits fragments cytoplasmiques dérivés d’une cellule précurseur, nommé
mégacaryocyte
- durée de vie : 9-10 jours
- il est difficile à les compter, parce qu’elle ont la tendance d’adhérer les unes aux autres
- nombre : 150000-400000/mm3
- sur le frottis : isolées ou, souvent, groupées en groupes de 4-5
- forme de disque biconvexe, un peu allongé ; le diamètre longitudinal 4 μm, le
diamètre transverse 2-2,5 μm
La structure
- la zone périphérique peu basophile, homogène, nommée hialomère
- la zone centrale azurophile, à un aspect fin granulaire, nommée granulomère (ou
chromomère)
ME
- membrane plasmique
- la face externe: une couche de glycocalix, qui lui confère une tendance d’adhésivité
aux surfaces
- des récepteurs pour les facteurs d’agrégation plaquettaire, des substances biologiques
actives, des hormones, du fibrinogène
- multiples zones d’invagination: forment un système tubulaire ouvert qui facilite
l’élimination des produits de catabolisme à l’extérieur
Le cytosquelette
- a le rôle de maintenir la forme de la cellule

- est formé par:
- un groupe marginal de microtubules
- des filaments contractiles disposés en zigzag
- la protéine contractile: trombostenine
Le granulomère contient
- glycogène, mitochondries, lysosomes
- système tubulaire fermé ou dense, avec des citernes de réticulum endoplasmique lisse,
avec une protéine de type calséquestrine pour attacher les ions de Ca
- prostaglandine
- des granules proprement dits
1. α, électron - transparents, 0,2-0,3 μm en diamètre, contenant:
- le facteur plaquettaire 4 (qui contrecarre l’héparine), le facteur plaquettaire 5, le
facteur plaquettaire 6 (le fibrinogène plaquettaire), PDGF
- thrombospondine, glycoprotéine, ayant un rôle dans l’agrégation plaquettaire
- le facteur von Willebrand, glycoprotéine qui facilite l’adhésion à la paroi vasculaire
2. β– électron -opaques, contenant des promoteurs de l’agrégation plaquettaire: le facteur
plaquettaire 5 (sérotonine), catécholamine, Ca, ADP, ATP
3. δ ou corps épais, 250-300 nm en diamètre, contenant Ca, pyrophosphate, ADP, ATP,
4. λ, vésicules de 175-250 nm, contenant des enzymes lysosomales
La fonction: d’initier et de participer à la réalisation de la hémostase et à la rétraction du
caillot
Les leucocytes
Nombre: 5000-9000 / mm3
- sur le frottis: ronds, avec noyau, dispersés parmi les hématies
- ils effectuent une migration, par la diapédèse, du sang vers les tissus, où ils
accomplissent leur fonction
Classification
- d’après les granulations cytoplasmiques: granulocytes, agranulocytes
- d’après la forme du noyau: polynucléaires, mononucléaires
- les granulocytes présentent des noyaux à plusieurs lobes, en correspondant aux
polynucléaires
- les agranulocytes présentent des noyaux sans lobes évidents, en correspondant aux
mononucléaires
- d’après la coloration des granules les granulocytes sont: neutrophiles, éosinophiles,
basophiles
En comptant sur un frottis de 100 jusqu'à 400 leucocytes, on détermine la formule
leucocytaire, qui représente la proportion des leucocytes d’un certain type à 100. Les valeurs
normales de la formule leucocytaire sont: neutrophiles 55-70%, éosinophiles 3-5%,
basophiles 0,5-1%, mononucléaires – lymphocytes 20-25%, mononucléaires – monocytes 5-
8%
Les neutrophiles
- diamètre: 7 μm dans le sang, 10-12 μm sur le frottis, à cause de l’étalement
- après un transit de 6-8 heures dans le sang, les neutrophiles passent, par la diapédèse
dans le tissu conjonctif, où elle accomplissent leur fonction et vont mourir en 1-4 jours
La structure
- le noyau – 2/5 lobes liés par des ponts fins de chromatine
- peuvent présenter des appendices: le corpuscule Barr, sous la forme d’une petite
prolongation, comme un bâtonnet, sur un lobe terminal, représentant le chromosome X
condensé

- les granulations cytoplasmiques – 3 types
- les granulations spécifiques: 80% de la totalité des granulations
- petites, 0,2-0,4 μm en diamètre, rondes, violacées dans la coloration MGG
- contiennent: lysozyme, lactoferine, phosphatase alcaline, collagènase et protéines
basiques (nommées phagocytines, ayant une activité non- enzymatique
antibactérienne)
- les granulations non- spécifiques: 15% de la totalité des granulations
- diamètre de 0,6 μm, colorées par l’azure en rouge -violet
- présentent une structure caractéristique de lysosome primaire, contenant:
myélopéroxydase, phosphatase acide, β-glucuronydase, α-manosydase, aril sulfatasse,
β-galactosidase, cathepsine, 5-nucléotidase, élastase, collagènase, lysozyme et des
protéines cationiques antibactériennes
- les granules nucléés
- identifiées en ME en très petit nombre; ils ont des dimensions moyennes; ils ont un
contenu cristalloïde
- d’autres éléments dans le cytoplasme: complexe Golgi rudimentaire, mitochondries,
RER réduit, des particules de glycogène
Les fonctions
- présentent mobilité, prouvée par l’aplatissement suivi d’une émission de pseudopodes,
au contact avec un substrat – les pseudopodes contiennent une matrice délicatement
granulaire à cause du contenu d’actine, myosine, microtubules et particules de
glycogène
- impliqués dans les réactions inflammatoires, ils sont les premiers qui apparaissent
dans le processus de la défense nonspécifique, en réalisant la phagocytose et la
digestion lysosomale des particules non self – expriment à la surface des nombreux
récepteurs pour Fc de l’IgG, C3, amines biologiques, hormones et facteurs
chémotactiques
- adhérent aux endothéliums grâce à une protéine de membrane, nommée L-CAM, et
aux cytokines Il-1β et TNF-α qui stimulent les cellules endothéliales à sécréter et à
positionner au niveau de la membrane plasmique E-LAM 1
Les éosinophiles
- diamètre de 13-14 μm
- durée de vie : jusqu'à 12 heures
La structure
MO
- le noyau est bilobé, en « bissac », aux lobes allongés, liés par un pont fin de
chromatine
- des granulations grandes, allongées, de dimension constante (0,6-0,8 μm) colorées par
l’éosine en rouge étincelant ou en rouge -orange et dispersées dans tout le cytoplasme
ME
- la zone centrale électron – opaque, parfois d’un aspect cristalloïde, de formes variées,
nommée internum
- une matrice délicatement granulaire qui l’entoure, nommée externum
- les granules représentent des lysosomes, contenant les enzymes suivantes :
peroxydase, phosphatase acide, aril sulfatasse, β-glucuronidase, cathepsine,
phospholypase, ribonucléase, histaminase et 3 protéines cationiques qui ne se trouvent
pas dans les lysosomes d’autres cellules : la protéine basique majeure (PBM), la
protéine cationique éosinophilique (PCE), neurotoxine éosinophilique
- les organites sont peu développés

Les fonctions
- les éosinophiles ont des récepteurs pour Fc de l’IgG et pour C3b
- les produits de catabolisme dégagés par les parasites déterminent l’apparition de l’IgG
antiparasitaire
- les surfaces des parasites peuvent activer le complément qui, par l’intermède des
anaphylatoxines, détermine la dégranulation des mastocytes et des basophiles, avec un
dégagement de petites quantités de facteurs chémotactiques pour les éosinophiles et
une vasodilatation
- se produit un afflux d’éosinophiles qui exocytent les granules
- les éosinophiles sont capables de réaliser une émission de pseudopodes et de
phagocyter les complexes Ag-Ac (phagocytose sélective)
Les basophiles
- diamètre 8-12 μm
La structure
- noyau – sur le frottis, souvent couvert de granulations
- ME : 2-3 lobes liés par des ponts courts et gros, en forme de S, avec hétéro chromatine
périphérique et euchromatine centrale
- Les granulations
- sphériques, jusqu'à 1 μm en diamètre et formes variées, grâce à la dissolution partielle
dans l’eau avec glycérine, intensément basophiles, métachromatiques avec bleu de
toluidine et thionine
- un aspect électron – opaque, granulaire, homogène et lamellaire
- elles contiennent les substances suivantes : péroxydase, héparine, histamine, des
facteurs chémotactiques pour les neutrophiles et éosinophiles et, après l’activation,
elles produisent : léucotrienes, prostaglandines, tromboxane et le facteur d’activation
plaquettaire
- la membrane présente des récepteurs pour Fc de l’IgE, pour C3a et C5a
Les fonctions
- contribuent à la défense antibactérienne et antiparasitaire par la diffusion du contenu
des granules ; elles peuvent aussi être dégranulées par C3a, C5a
- dans les atteintes allergiques, les basophiles réagissent tout comme les mastocytes.
Dans les organismes sensibilisés il se produit une dégranulation massive, et elles
déterminent, avec les monocytes (à coté des mastocytes), une réponse exagérée
Origine
- les basophiles et les mastocytes présentent un précurseur commun pendant la vie
embryonnaire, mais les mastocytes sont celles qui peuplent précocement le tissu
conjonctif où elles s’établissent, pendant que les basophiles sont produites durant toute
la vie par la moelle osseuse, ayant un court transit dans le sang
Les lymphocytes
- représentent le type prédominant d’agranulocytes
- un diamètre de 8-12 μm, classifiés d’après leur dimension en 3 groupes :
- petits, mûrs, ayant un diamètre de 8 μm
- moyens, en cours de maturation, un diamètre de 10 μm, cytoplasme réduit
- gros, jeunes, un diamètre de 12 μm, cytoplasme abondant; couleur bleu -clair
- noyau unique, très coloré, rond ou délicatement indenté
- nucléole visible
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%