I – Réactions d`oxydo-réduction, oxydant, réducteur

COURS VII : LES REACTIONS D’OXYDO-REDUCTION
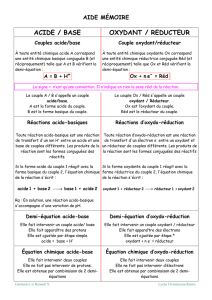
I – RÉACTIONS D’OXYDO-RÉDUCTION, OXYDANT, RÉDUCTEUR
1 – Exemples
Voir TP
2 – Définitions
Définition d’une réaction d’oxydo-réduction :
C’est une réaction caractérisée par un transfert d’électrons entre un oxydant et un réducteur.
Ex : réaction entre Fe et Cu2+(aq)
Fe(s) + Cu2+(aq) Fe2+(aq) + Cu(s)m
Définition d’un oxydant :
Un oxydant est une espèce chimique (molécule ou ion) capable de capter un ou plusieurs électrons lors
d’une réaction chimique.
Définition d’un réducteur :
Un réducteur est une espèce chimique (molécule ou ion) capable de céder un ou plusieurs électrons lors
d’une réaction chimique.
Définition d’une oxydation :
Une oxydation est une perte d’électrons.
Définition d’une réduction :
Une réduction est un gain d’électrons.
3 – Oxydants et réducteurs dans la classification périodique
En classe de 2nde, nous avons vu qu’un élément dont la dernière couche n’est pas remplie complètement
tend à acquérir la structure du gaz rare le plus proche.
- S’il tend à gagner des électrons, c’est un oxydant.
- S’il tend à perdre des électrons, c’est un réducteur.
Exemples :
Na (gaz rare le plus proche Ne) : tend à perdre 1 é ; c’est le réducteur du couple Na+/Na.
I2 (gaz rare la plus proche Xe) : tend à gagner 1 é ; c’est l’oxydant du couple I2/I-.
oxydants
réducteurs

II – COUPLE OXYDANT-REDUCTEUR
1- Définition
Un couple oxydant/réducteur est constitué d’un oxydant et d’un réducteur qui se transforment l’un en
l’autre par un transfert d’électrons.
Oxydant + né = réducteur
Exemples :
- couple Fe2+/Fe Fe2+ + 2é = Fe
(oxydant) (réducteur)
- couple I2/I- I2 + 2é = 2I-
2 – Equilibre d’une demi-équation associée à un couple
La demi-équation respecte les même règles d’ajustement de la stoechiométrie que les équations
chimiques.
Méthode d’équilibre d’une demi équation redox en milieu acide :
- Ecrire la demi-équation sous la forme Ox + né = red
- Assurer, si nécessaire la conservation des éléments autres que H et O.
- Assurer la conservation de l’élément O avec des molécules d’eau.
- Assurer la conservation de l’élément H avec des protons H+.
- Assurer la conservation de la charge avec des électrons.
Méthode d’équilibre d’une demi équation redox en milieu basique :
- Equilibrer la demi-équation en milieu acide.
- Ecrire l’autoprotolyse de l’eau avec autant d’H+ que dans l’équation précedente
Autoprotolyse de l’eau : H+ + HO- H2O
- Additionner les deux équations précédentes de manière à éliminer les H+.
a) Exemples de couples cation métallique / métal
Cu2+(aq) + 2é = Cu(s) Zn2+(aq) + 2é = Zn(s) Pb2+(aq) + 2é = Pb(s) Al3+(aq) + 3é = Al(s) …
b) Exemple de couple cation métallique / cation métallique
Fe3+(aq) + é = Fe2+(aq)
c) Exemples de couples ion métallique / molécule
2H+(aq) + 2é = H2(g) I2(aq) + 2é = 2I-(aq)
d) Exemples de couples dans lequel un élément commun s’associe à l’oxygène
S2O82-(aq) + 2é = 2SO42-(aq)
S4O62-(aq) + 2é = S2O32-(aq)
Equilibre en milieu acide :
MnO4-(aq) + 8H+ + 5e = Mn2+(aq) + 4H2O
O2 + 2H+ + 2é = H2O(l)
2HClO(aq) + 2H+ + 2é = Cl2 + 2H2O

Cr2O72-(aq) + 14H+ + 6é = 2Cr3+(aq) + 7H2O
Equilibre en milieu basique :
IO3-(aq)/I-(aq) IO3- + 6é + 6H+ I- + 3H2O
6H2O 6H+ + 6HO-
IO3- + 6é + 3H2O I- + 6HO-
ClO-(aq)/Cl2(g) 2ClO- + 2é + 4H+ Cl2 + 2H2O
4H2O 4H+ + 4HO-
2ClO- + 2é + 2H2O Cl2 + 4HO-
MnO4-(aq)/MnO2(s) MnO4-(aq) + 3é + 4H+ MnO2(s) + 2H2O
4H2O 4H+ + 4HO-
MnO4-(aq) + 3é + 2H2O MnO2(s) + 4HO-
III – EQUATION CHIMIQUE D’UNE REACTION D’OXYDO-REDUCTION
1 – Caractéristiques
Une réaction d’oxydo-réduction fait intervenir deux couples oxydant/réducteur.
Pour obtenir l’équation d’une réaction d’oxydo-réduction, on peut additionner les deux demi-équations
de chacun des couples oxydant/réducteur mis en jeu.
Réaction entre un oxydant 1 et un réducteur 2 appartenant respectivement aux couples oxydant 1/
réducteur 1 et oxydant 2/ réducteur 2 :
n' x (oxydant 1 + né = réducteur 1)
n x (réducteur 2 = oxydant 2 + n’é)
oxydant 1 + réducteur 2 + n’né réducteur 1 + oxydant 2 + nn’é
oxydant 1 + réducteur 2 réducteur 1 + oxydant 2
2 – Exemples
Voir TP
Réaction entre la vitamine (ou acide ascorbique) C2H8O6 et le diiode
Couples : C2H6O6 /C2H8O6 I2 / I-
C2H8O6 = C2H6O6 2é + 2H+
I2 + 2é = 2I- .
C2H8O6 + I2 = C2H6O6 + 2I- + 2H+

EQUILIBRE D’UNE DEMI-EQUATION ASSOCIEE A UN COUPLE
La demi-équation respecte les même règles d’ajustement de la stœchiométrie que les équations chimiques.
Méthode d’équilibre d’une demi équation redox en milieu acide :
- Ecrire la demi-équation sous la forme Ox + né = red
- Assurer, si nécessaire la conservation des éléments autres que H et O.
- Assurer la conservation de l’élément O avec des molécules d’eau.
- Assurer la conservation de l’élément H avec des protons H+.
- Assurer la conservation de la charge avec des électrons.
Méthode d’équilibre d’une demi équation redox en milieu basique :
- Equilibrer la demi-équation en milieu acide.
- Ecrire l’autoprotolyse de l’eau avec autant d’H+ que dans l’équation précedente
Autoprotolyse de l’eau : H+ + HO- H2O
- Additionner les deux équations précédentes de manière à éliminer les H+.
Ecrire les demi-équation pour les couples suivants :
a) Exemples de couples cation métallique / métal
Cu2+(aq)/Cu(s) :…………………… Pb2+(aq)/Pb(s) : ……………………
Zn2+(aq)/Zn(s) : …………………… Al3+(aq)/Al(s) : ……………………
b) Exemple de couple cation métallique / cation métallique
Fe3+(aq)/Fe2+(aq) : ……………………
c) Exemples de couples ion métallique / molécule
H+(aq)/H2(g) : …………………… I2(aq)/I-(aq) : ……………………
d) Exemples de couples dans lequel un élément commun s’associe à l’oxygène
S2O82-(aq)/SO42-(aq) : ………………………. S4O62-(aq)/S2O32-(aq) : ……………………
Equilibre en milieu acide :
MnO4-(aq)/Mn2+(aq) : …………………………………………………..
O2/H2O(l) : ……………………………………………………………
HClO(aq)/Cl2 : ………………………………………………………..
Cr2O72-(aq)/Cr3+(aq) : …………………………………………………..
Equilibre en milieu basique :
IO3-(aq)/I-(aq) : MnO4-(aq)/MnO2(s) :
ClO-(aq)/Cl2(g) :

EXERCICES SUR LES OXYDANTS ET LES REDUCTEURS
Exercice 1 :
I- Ecrire les demi-équations électroniques des 4 couples suivants.
MnO4-(aq) / Mn2+(aq) ; NO3- (aq) / NO(g) ; SO42-(aq) / SO2(aq) ; Cr2O72-(aq) / Cr3+(aq).
II – Ecrire l’équation chimique de la réaction d’oxydo-réduction suivante: Oxydation d’ une solution aqueuse
de dioxyde de soufre par une solution de permanganate de potassium acidifiée ?
III– Préciser dans l’équation chimique de la réaction d’oxydo-réduction
2 S2O3 2- (aq) + I2 (aq) 2 I-(aq) + S4O62- (aq)
1- Par 2 flèches annotées : l’oxydation et la réduction.
2- Le nom de l’oxydant, le nom du réducteur.
3- Le nom du réducteur conjugué de l’oxydant.
4- Préciser la ou les espèces colorées.
IV - Une eau-forte est une gravure obtenue en dessinant sur la plaque de cuivre recouverte d’un vernis
protecteur à l’aide d’une pointe qui met le cuivre à nu. On verse alors de l’acide nitrique (H+(aq) + NO3-(aq))
qui agit comme un burin chimique attaquant le cuivre non protégé.
Au cours d’une opération de gravage, du monoxyde d’azote est dégagé.
2NO3 - (aq) + 3 Cu (s) + 8H+(aq) 2 NO(g) + 3 Cu2+(aq) + 4 H2O
1- Donner les couples oxydant-réducteurs et les demi-équations permettant d’obtenir l’équation de cette
réaction.
2- Retrouver l’équation
3- Donner le nom de l’oxydant ; du réducteur.
Exercices livre :
9, 13, 14, 16, 22, 24, 29, 30 p 97 à 100.
 6
6
1
/
6
100%