TP1bis_synthesearomebanane

Synthèse d’un arôme
Compétences travaillées:
Me préoccuper des consignes de sécurité (pour les personnes, le matériel, l'environnement) et suivre les règles
de vie de classe.
F1
Suivre un protocole en respectant une suite de consignes
F2
Objectif :
Effectuer de manière élémentaire la synthèse d’un arôme et deviner
à quel fruit fait penser l'odeur qui s'en dégage.
Risques et précautions
Acide
Acétique
Alcool
Isoamylique
Acide
sulfurique
C : Corrosif
Xn : Nocif
Corrosif
R - 10
Inflammable
x
x
R - 35
Provoque des brûlures
x
x
x
R - 20
Nocif par inhalation
x
S – 23
Ne pas respirer les gaz et les vapeurs
x
S – 24
Éviter le contact avec la peau
x
S – 25
Éviter le contact avec les yeux
x
S – 26
En cas de contact avec les yeux, laver
immédiatement et abondamment avec
l’eau
x
x
x
1) D’après les pictogrammes des substances utilisées, quelles précautions dois-tu prendre lors des
manipulations ?
_______________________________________________________________________________________________
_______________________________________________________________________________________________
_______________________________________________________________________________________________
_______________________________________________________________________________________________
_______________________________________________________________________________________________

Expérience
Pour fabriquer cet arôme, tu vas réaliser une transformation chimique entre l’acide acétique et l’alcool
isoamylique.
Protocole expérimental
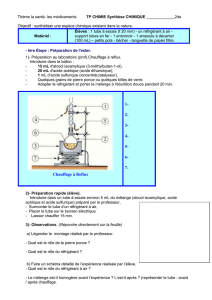
Etape n°1 : Synthèse de l’arôme
- Préparer un bain-marie en chauffant environ 100 mL d’eau du robinet dans un bécher de 250 mL.
Introduire un thermomètre pour surveiller la température du bain marie : entre 70°C et 80 °C.
Pour éviter de chauffer trop rapidement les réactifs, on utilise un bain-marie. Le bain-marie est une
technique de chauffage qui utilise un récipient rempli à moitié d’eau (ou d’huile) et dans lequel on place le
récipient contenant la préparation à chauffer. Ce dispositif est principalement utilisé en chimie et en
cuisine. Il présente l’avantage de ne pas avoir un apport de chaleur trop brutal. On utilise de l’huile lorsque
l’on désire atteindre des températures supérieures à 100°C.
- Dans un tube à essais, introduire 4 mL d’acide acétique pur prélevés à l’aide d’une éprouvette graduée de
capacité 25 mL
- Puis 4 mL d’alcool isoamylique prélevés à la burette
- Faire ajouter alors par le professeur quelques gouttes d’acide sulfurique concentré.
(Remarque : cet acide n’est pas un réactif, il n’est là que pour permettre que la réaction se produise plus
rapidement : c’est un catalyseur).
- Fermer le tube à essai avec le bouchon muni de son tube en verre appelé réfrigérant à air.
Lorsque les réactifs utilisés sont trop volatils (qui s’évaporent facilement), on
utilise un chauffage à reflux. Ainsi, les gaz qui s’échappent du tube à essais se
liquéfient au contact du réfrigérant à air et les liquides retombent dans le
mélange. Pour réaliser un tube réfrigérant de manière
élémentaire, on peut utiliser un bouchon muni
d’un long tube en verre qui peut s’adapter sur un
tube à essais.
- Placer le tube à essais dans le bain-marie (à 80-90 °C) pendant 15 minutes.

2) Ajouter un titre au schéma suivant et légender à l’aide du vocabulaire :
eau à 90°C, bécher, tube à essais, mélange réactionnel, réfrigérant à air, chauffage
Etape n°2 : Extraction de l’arôme
- Retirer le tube à essais (attention à ne pas se brûler !) du bain-marie et le laisser refroidir 5 minutes dans le porte
tube.
- Pendant que le tube à essais refroidit, verser de l’eau (environ 100 mL) dans un verre à pied et dissoudre du sel
dedans jusqu’à saturation. (c’est-à-dire jusqu’à ce que le sel ne se dissolve plus).
- Après refroidissement, verser le contenu du tube à essais dans le verre à pied contenant l’eau salée saturée.
- Agiter et laisser décanter. Observer.
L’acétate d’isoamyle, n’étant pas soluble dans l’eau salée saturée, se retrouve en surface.
3) Cocher la case qui correspond aux observations :
□ A. Le mélange est hétérogène donc les liquides sont miscibles entre eux
□ B. Le mélange est homogène donc les liquides sont miscibles entre eux
□ C. Les liquides sont non miscibles entre eux car le mélange est hétérogène
□ D. Les liquides sont non miscibles entre eux car le mélange est homogène
- Verser ensuite le contenu du verre dans une ampoule à décanter posée sur le bureau.
Agiter, puis laisser décanter.

- Dans un bécher, préparer 75 mL d'une solution saturée d'hydrogénocarbonate de sodium.
Utilisation d’une ampoule à décanter
On extrait un soluté d'une solution en le faisant passer d'un solvant à un autre non miscible avec le
premier.
Pour séparer la solution aqueuse de la partie organique:
- Introduire dans l'ampoule la solution à extraire puis ajouter la solution saturée d'hydrogénocarbonate de
sodium pour neutraliser l'acide en excès.
- Fermer avec un bouchon rodé.
- Prendre l'ampoule à deux mains. Tenir le bouchon d'une main en le maintenant bien appuyé pour éviter
toute fuite. Tenir le robinet de l'autre main.
- Agiter en renversant l'ampoule. Cette agitation peut provoquer une légère vaporisation des composés et
créer une surpression dans l'ampoule.
- De temps en temps, procéder à un "dégazage" de l'ampoule tout en maintenant le bouchon fermé:
incliner l'ampoule et ouvrir doucement le robinet.
- Placer l'ampoule sur son support et ôter le bouchon. Laisser les liquides non miscibles se séparer.
- Evacuer toute la solution aqueuse inférieure.
- Deux types de solutions sont contenus dans l’ampoule à décanter :
la phase aqueuse et la phase organique. On observe une séparation entre les deux.
L’acétate d’isoamyle que l’on cherche à isoler se trouve dans la partie qui surnage (phase organique).
4) Légender le schéma suivant :
- Eliminer la phase aqueuse se trouvant « en dessous » et récupérer dans un bécher propre la phase
organique.
- Tremper une bande de papier filtre dans le bécher et sentir le produit en agitant doucement la bande.
- Il ne faut pas goûter l’arôme synthétisé !
- Nettoyer et ranger le matériel

5) Quels sont les réactifs de cette synthèse ?
__________________________________________________________________________
6) Donner le nom d’un des produits de cette synthèse ?
__________________________________________________________________________
7) A quel fruit fait penser l'odeur qui s'en dégage ?
_________________________________________________________________________
8) A quoi sert l’acide sulfurique ajouté ?
_________________________________________________________________________
_________________________________________________________________________
9) Pourquoi utiliser un tube réfrigérant ?
__________________________________________________________________________
_________________________________________________________________________
10) Pourquoi l’arôme artificiel n’est-il pas exactement identique à l’arôme naturel ?
__________________________________________________________________________
__________________________________________________________________________
Conclusion
_______________________________________________________________________________________________
_______________________________________________________________________________________________
_______________________________________________________________________________________________
_______________________________________________________________________________________________
_______________________________________________________________________________________________
_______________________________________________________________________________________________
_______________________________________________________________________________________________
_______________________________________________________________________________________________
_______________________________________________________________________________________________
_______________________________________________________________________________________________
1
/
5
100%