Le cytosquelette

1
Le cytosquelette
Introduction :
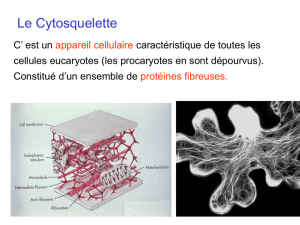
Dans ce cours, nous nous focaliserons sur la structure du cytosquelette qui est en fait constitué par
des filaments, des tubules de nature protéique. Ces éléments du cytosquelette cellulaire, sont classés
dans trois familles très conservées au cours de l'évolution, nous les décrirons les unes après les autres
:
- les filaments d'actine, : 10 nm
- les filaments intermédiaires : entre 10 nm et 25 nm.
- les microtubules : 25 nm
Diapo 1 : Trouver les différents éléments du cytosquelette : indices :
les microtubules et le centre cellulaire,
les filaments intermédiaires, ici sont représentées les lamines nucléaires
l'actine, ici on vous montre qu'elle forme un réseau dense cortical sous membranaire.
Généralités
Ces différents éléments du cytosquelette cellulaire sont d'une façon générale organisés de la même
façon, ils résultent tous de la polymérisation de "maillons élémentaires" que l'on va nommer par
éléments / protéine dite "monomères".
Ces mécanismes de polymérisation vont être réalisés en général dans un sens précis, ce qui va
déterminer une extrémité négative et une extrémité positive au filament / tubule. L'extrémité
négative est en fait le début du filament (origine de la polymérisation) et l'extrémité positive est
la partie du filament qui est en cours de polymérisation par addition de monomères.
Le cytosquelette forme un réseau complexe de filaments et tubules qui s'étend dans tout le
cytoplasme. Le cytosquelette est une structure très dynamique qui se réorganise continuellement
au cours des différents évènements du cycle cellulaire (migration, déplacement, division, etc.).

2
Les familles des microtubules et des filaments d'actine sont très homogènes et ont été
très étudiées.
Ces deux familles sont présentes dans toutes les cellules et les molécules constitutives sont bien
connues et toujours les mêmes (tubuline dans un cas, actine dans l'autre).
Les filaments intermédiaires sont en revanche plus hétérogène (ex : kératines, lamines,
desmines...), constitués de molécules qui diffèrent selon le type cellulaire, en fait dans ce cours
on en reparlera certes , mais de façon assez succincte.
Ce cytosquelette possède de nombreuses fonctions :
- défense contre les agressions mécaniques,
- maintien de la forme de la cellule
- mouvements cellulaires
- implication dans les mécanismes d'adhésion cellulaire.
- division cellulaire (fuseau + anneau actine cytodiérèse)
- transports intra-cytoplasmiques (vésicules le long neurotubules)
J'oublie probablement d'autres rôles physiologiques de ce cytosquelette cellulaire...
A ce réseau fibrillaire d'autres types de protéines peuvent se fixer. Différents types de protéines vont
interagir avec le cytosquelette, qui sont regroupées en familles, dont voici deux exemples :
- protéines de liaisons entre les filaments / tubules et/ou avec le reste de l'architecture cellulaire :
protéines de pontages, protéines impliquées dans l'interaction avec les membranes, points
d'ancrage...
- protéines impliqués dans des mécanismes de motilité : en général ces protéines sont
consommatrices d'énergie (ATP), globalement, on classe ces protéines dans la catégorie des moteurs
moléculaires. Elles possèdent un point d'ancrage sur les filaments qui leur permet de se
déplacer le long de ceux ci, et également un autre point d'ancrage sur l’élément à transporter
ce qui leur permet de transporter des protéines ou organites le long de ce réseau.

3
I. Actine
Carrefour cellulaire (2 dia)
Les principaux rôles de l’actine (1 dia)
Visualisation et méthodes d’études (1 dia)
Dans de nombreuses cellules animales c'est la protéine la plus abondante, puisqu'elle peut
représenter jusqu'à 10 % des protéines totales dans les cellules non musculaires, et jusqu'à 60 %
dans les cellules musculaires. Autant dire qu'elle possède des rôles prépondérants dans la vie de la
cellule.
Cette protéine est quasi ubiquitaire, puisqu'elle est présente dans quasiment toutes les cellules
eucaryotes. Cette protéine est également très conservée au cours de l'évolution (plus de 90 %
de conservation entre la levure et l'homme).
Les filaments d'actine forment des structures dynamiques qui sont plus au moins stables selon le
degré d'interaction avec des protéines associées (dont la fonction de certaines est justement de
stabiliser ces filaments).
Les formes les plus stables de ces filaments sont retrouvées dans les cellules musculaires et dans
les entérocytes avec les microvillosités retrouvées aux pôles apicaux de ces cellules. Par contre,
dans une cellule en mouvement, les filaments d’actine qui participent au mouvement
(amoeboïde) correspondent à des filaments non stables en constante polymérisation et
dépolymérisation.
L'actine, est codée par six gènes chez l’homme, qui sont nés de la duplication d’un gène primitif
et qui ont ensuite évolué séparément.
C’est une protéine qui se lie à l'ATP, et qui possède un poids moléculaire d'environ 43 kDa.
La diversité moléculaire entre les six types d'actine (on parle d’isoformes) est très faible
puisqu'on relève plus de 90 % d'identité dans leur séquence d'acides aminés. La partie variable
concerne les 30 acides aminés du coté amino-terminal (sur un total de 375 résidus). Ces isoformes
sont spécifiques des tissus comme les cellules musculaires avec des isoformes cardiaque,
vasculaire, squelettique (actines ), ou de cellules non musculaires (actines et ).
On a longtemps pensé que les gènes de l’actine étaient très conservés au cours de l’évolution, c’est
vrai, mais on aussi mis en évidence récemment la présence de protéines de la même famille

4
que l’actine mais qui ont plus fortement divergé puisque la conservation de séquence n’atteint
pas les 60 %. Ces protéines de la même famille que l’actine (on parle de protéines associées à
l’actine) prennent le nom de Arps (pour actine related proteins)
On relève aussi évidemment de l’actine dans les plantes, leurs gènes ont par contre beaucoup plus
divergé que pour les animaux.
Chez les procaryotes, il a été identifié récemment des gènes codant pour un cytosquelette bactérien,
qui se révèlent être en fait les ancêtres de l’actine. Je n’en dirais pas plus.
Les protéines qui s’associent à l’actine :
Elles sont classées en de nombreuses familles, ces protéines régulent la dynamique et
l’organisation des filaments d’actine dans la cellule. Globalement, on peut distinguer les
protéines qui se lient au monomère d’actine, celles qui sectionnent les filaments, coiffent les
filaments, établissent des liaisons croisées dans les filaments, stabilisent les filaments ou se
déplacent le long des filaments d’actine. Beaucoup de ces protéines sont modulaires, c’est à
dire qu’elles possèdent des domaines analogues de liaisons à l’actine, mais possèdent d’autres
régions qui vont déterminer leur rôle dans la cellule.
C’est le cas par exemple des myosines et des protéines de réticulation (forment les réseaux).
Les protéines de liaison au monomère de l’actine :
Le rôle principal de ces protéines va être de contrôler le pool d’actine monomère non polymérisé
ainsi que la possibilité d’échange ATP/ADP de l’actine au niveau de ce monomère.
Les thymosines : ce sont de petits peptides de 43 résidus qui vont se lier aux monomères
d’actine ATP préférentiellement, qui vont inhiber la polymérisation de l’actine.
Les membres de la famille ADF/cofiline (ADF, pour Actine Destabiling Factor) : Ces
protéines se lient préférentiellement à l’actine ADP, et vont empêcher l’échange de nucléotides.
Lorsque ces protéines se lient à l’actine ADP présente dans les filaments, il en résulte une
déstabilisation de ces filaments et une coupure du filament liée à la perturbation de
l’enroulement hélicoïdal du filament d’actine.
Les profilines : Ces profilines se lient préférentiellement à l’actine dépourvue de nucléotide, mais
aussi aux formes de l’actine ADP et ATP, l’effet de cette fixation va accélérer l’échange du

5
nucléotide. De par leur fixation sur l’actine, les profilines encouragent la polymérisation de
l’actine à l’extrémité positive du filament. Les complexes actine-ATP/profiline sont ensuite
transportés vers l’extrémité positive du filament, et vont donc constituer un pool d’actine
disponible pour l’élongation du filament.
préférentiellement : fixation plutôt sur une forme de l’actine, mais cette fixation peut toucher de façon
secondaire les autres formes de l’actine.
Les protéines de coiffe (capping) de l’actine :
Ces protéines se lient à l’une ou à l’autre des extrémités des filaments d’actine, ou elles vont
bloquer l’allongement des filaments. Enfin, certaines protéines de coiffes vont segmenter les
filaments d’actine.
La gelsoline : Les protéines de la famille de la gelsoline possèdent toutes six domaines. Ces
protéines sont activées par la fixation de calcium (qui doit donc être en forte concentration au
voisinage de la gelsoline), et ainsi, ces protéines vont se lier sur le corps du filament (induit une
cassure du filament) ou à son extrémité (positive), et vont ainsi bloquer à la fois la dissociation
ou l’association de sous-unités d’actine.
Les protéines de coiffe à trois domaines, comme la fragmine et la séverine, sont des protéines qui
possèdent des domaines analogues aux trois premiers domaines des gelsolines (on pense à
une duplication de ces gènes qui auraient donné naissance aux gènes de la gelsoline).
Les protéines de coiffe hétérodimériques : elles sont formées de deux sous unités d’environ 30
kD. Elles coiffent les extrémités positives des filaments avec une grande affinité. Ex : protéine CapZ.
Le complexe Arp 2/3, constitué par deux protéines associées à la famille de l’actine (Arp 2 et Arp
3), va venir coiffer l’extrémité négative du filament d’actine, et il constitue un facteur de
nucléation de l’actine.
La tropomoduline, elle coiffe les filaments d’actines dans les muscles , ceci se fait en présence de
tropomyosine, qui est une protéine qui se fixe sur toute la longueur du filament d’actine.
Les protéines de fragmentation des filaments d’actine.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%