Chim5 CONDUCTIMETRIE

1S
Chim4
Cours
Conductance et conductivité d’une solution ionique
I. Rappels d’électricité
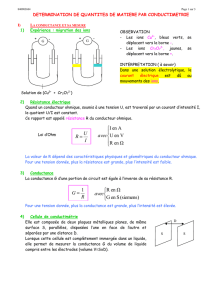
1. Courant électrique dans une solution électrolytique
Expérience de migration des ions.
Le passage du courant électrique dans une solution résulte d’une double
migration des anions et des cations se déplaçant en sens inverse.
Les cations (chargés +) se déplacent vers la cathode (électrode reliée au –
du générateur)
Les anions (chargés -) se déplacent vers l’anode (électrode reliée au + du
générateur).
2. La loi d’Ohm
Pour deux électrodes plongées dans une solution électrolytique.
La loi d’ohm s’écrit : avecU tension en volts (V)
I intensité du courant en ampères (A)
R résistance en ohm ().
Cela signifie que la tension électrique U imposée par le générateur est proportionnelle à l’intensité I du courant
électrique qui traverse la portion de solution électrolytique comprise entre les électrodes.
II. Conductance d’une portion de solution électrolytique (voir activité)
1. Définition
La conductance G d’une portion de circuit électrique est égale à l’inverse de sa résistance.
2. Mesure de la conductance
Expérience 1 : cellule conductimétrique artisanale en courant continu.
En courant continu, des transformations chimiques peuvent avoir lieu aux électrodes : c’est une électrolyse. Cela va
influencer l’intensité et la tension.
Expérience 2 : la même cellule en courant alternatif (500 Hz)
En courant alternatif, le phénomène d’électrolyse disparaît. Les mesures sont fiables.
Conclusion : On ne mesure pas la conductance en courant continu.
3. Influence du système de mesure (Cellule conductimétrique artisanale à géométrie variable)
Expérience 1 : La surface S des électrodes varie, mais l’écart entre les deux électrodes est le même (variation de
la hauteur immergée des électrodes) :
Lorsque la surface S des électrodes augmente, la conductance G …………………………………..(I augmente) car il y a
davantage …………………………………susceptibles de migrer.
Expérience 2 :L’écart L entre les électrodes varie mais la surface immergée reste la même (variation de la
dimension de la cellule). :
Lorsque l’écart L entre les électrodes augmente, G ………………………… (I diminue) car la résistance R ……………….
4. Constante de cellule
Soient deux électrodes formant une cellule conductimétrique dont la surface immergée est S et la distance les séparant
est L, on appelle constante de cette cellule la valeur du rapport
Cette valeur caractérise la géométrie de la cellule conductimétrique.
III. Conductivité d’une solution électrolytique
1. Définition
La conductance d’une portion de circuit électrolytique est proportionnelle à S/L.
V
Anode
Cathode
Anion
Cation
+
-
-
+
Conclusion : Lorsqu’on étudie l’influence d’une solution électrolytique sur la conductance, il faut conserver la même
géométrie du système de mesure ( la même cellule)

Application : on mesure la conductance G= 40 mS d’une solution de chlorure de magnésium de concentration
inconnue. La surface des électrodes est de 1,0 cm2 et elles sont espacées de 4,0 cm.
1. Donner la formule de la solution.
2. Calculer la conductivité de cette solution.
2. Facteur influant sur la conductivité d’une solution d’un soluté unique
La concentration (voir TP « Détermination par conductimétrie de la concentration d’une solution
de sérum physiologique)
Expérience : on mesure la conductivité des solutions de chlorure de sodium de concentrations
12
1mol.L01C
;
13
2mol.L105C
;
31
3
C 2,5 10 mol.L
avec la même cellule.
Concentrations
12
1mol.L01C
13
2mol.L105C
31
3
C 2,5 10 mol.L
Conductivité
Conclusion :
Plus la concentration est élevée, plus la conductivité est grande car il y a plus de porteurs de charges.
Quand la concentration C double, la conductivité double : ……………………………………………………………………….
La nature de l’électrolyte
Expérience : mesure de la conductance (et donc de la conductivité) de diverses solutions avec la même cellule.
Solutions de KCl, NaCl, NaHO, KHO à
12 mol.L01C
Solution
K++Cl-
Na++Cl-
Na++HO-
K++HO-
Conductivité
Conclusion : …………………………………………………………………………………………………………………………….
La température (voir activité 6 page 81)
Lorsque la température augmente, l’agitation des ions augmente.
La conductance de la portion de solution augmente quand la température augmente car les ions sont plus mobiles.
Pour une bonne reproductibilité des mesures, la température doit être connue et rester constante d’une mesure à
l’autre. Électrodes et solution doivent être en équilibre thermique.
IV. Conductivité molaire ionique
1. Conductivité d’une solution ionique
Pour des solutions ioniques suffisamment diluées (c inférieure ou égale à 10-2 mol.L-1, d’où la dilution du serum étudié
en TP), la conductivité d’un électrolyte est proportionnelle à sa concentration. (Voir TP)
Remarque :
G en siemens (S)
est la ……………………. de la solution (en S.m-1)
S/L constante de la cellule conductimétrique (en m).
conductivité en
1
S.m
la …………………………………………. de l’électrolyte
qui s’exprime en
21
S.m .mol
C concentration en
3
mol.m
ATTENTION à l’unité !!!!
est une caractéristique de la solution, elle ne dépend que des facteurs physico-chimique relatifs à la solution mais
pas du système de mesure.
représente la capacité d’une solution à …………………………………………………………………………………

2. Conductivité molaire ionique d’un ion
A l’intérieur d’une solution électrolytique, chaque ion apporte sa contribution au passage du courant électrique.
La conductivité de la solution ionique est la somme des conductivités ioniques des ions qu’elle contient donc on a :
ii
σσ
On caractérise la contribution de chaque ion par une conductivité molaire ionique
i
λ
.
La conductivité ionique d’un ion monochargé est égale au produit de sa conductivité molaire ionique
i
λ
par sa
concentration
i
X
soit avec
i
X
en
3
mol.m
;
i
λ
en
12.molS.m
et
i
σ
en
1
S.m
3. Conductivité d’une solution ionique contenant plusieurs ions monochargés
La conductivité de la solution ionique est :
iii Xλσ
Exemple pour des ions monochargés : Pour l’électrolyte MX dont l’équation de dissolution est
-
(aq)(aq)(s) XMMX
on a :
]M[λσ (aq)
MM
et
]X[λσ (aq)
XX
La conductivité de la solution ionique est donc
]X[λ]M[λσσσ (aq)
X
(aq)
MXM
Soit C la concentration de la solution de l’électrolyte MX, on a
C][X][M (aq)(aq)
.
On en déduit donc :
C)λ(λσ XM
on pose
XM λλ
d’où ……………………………………….
Application1 : Calculer la concentration molaire de la solution de chlorure de magnésium étudiée dans l’application
précédente.
Données : λMg2+ = 11,00 mS.m2.mol-1 et λCl- = 7,63 mS.m2.mol-1
Application2 : une solution contient des ions sodium, chlorure et iodure dont les concentrations molaires sont
[Na+] = 2,1.10-3 mol.L-1 ; [Cl-] = 9,0.10-4 mol.L-1 et [I-] = 1,2.10-3 mol.L-1. Calculer la conductivité de la solution.
4. Remarques (tableau des conductivités molaires ioniques page 84)
Pour des solutions très diluées (
12 mol.L10C
), les conductivités molaires ioniques
i
λ
varient peu avec la
concentration mais dépendent de la température.
Les ions
OH3
(
(aq)
H
) et
HO
ont une conductivité molaire ionique nettement plus grande que celle des autres ions,
donc leur présence dans une solution confère à celle-ci une conductivité importante.
Exercices nº8, 10, 12, 14, 19, 20 et 22 page 93.
La valeur de la conductivité σ peut être calculée à partir des conductivités molaires ioniques λi des ions qui
composent cette solution, ainsi que leur concentration [Xi]
Inversement les mesures de conductimétrie permettent de déterminer la concentration des ions contenus
dans cette solution
ii
i
σ λ X
1
/
3
100%