THEME-I.Chap3_

CHAPITRE 3 : LA FIBRE MUSCULAIRE UTILISE ET REGENERE
L’ATP
3.1 Les muscles
Muscles squelettiques (aspect strié, longues fibres parallèles)
Muscle cardiaque (aspect strié, fibres courtes ramifiées)
Muscles lisses (muscles viscéraux)
TD: comprendre l'organisation d'un muscle squelettique
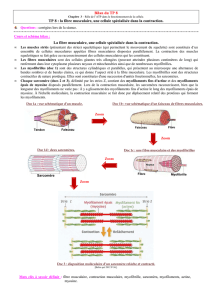
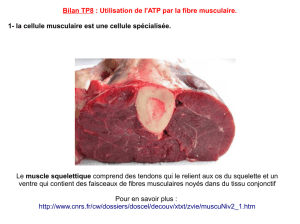
Les muscles striés squelettiques (pouvant constitués 45% de la masse corporelle d’un individu,
variables en fonction de l’âge et du sexe) sont constitués de deux parties distinctes: le ventre
(texture molle et fibreuse à laquelle la myoglobine donne sa couleur rouge) partie contractile et les
tendons (texture plus coriace de couleur blanc nacré) assurant la liaison aux os.
Le ventre du muscle est constitué de faisceaux de fibres, de fibres musculaires elles-mêmes
constituées de myofibrilles. Au regard de leur taille les myocytes sont appelés fibre musculaire. Elles
peuvent contenir plusieurs centaines de noyaux disposés à leur périphérie : il s’agit de grandes
cellules plurinucléées. Au microscope optique, la cellule apparaît striée longitudinalement et
transversalement ; en effet la fibre musculaire ou myocyte est constitué d’unités contractiles
constituées de bandes claires et de bandes sombres, de plus chaque myocyte contient plusieurs
myofibrilles disposées en parallèles. Chaque unité contractile est appelée sarcomère. Ces derniers
sont constitués de myofilaments visibles au microscope électronique ; des myofilaments fins
composés d’actine entourant des myofilaments épais composés de myosine. Les zones opaques ou
sombres donnent son aspect caractéristique au muscle aux endroits où les myofilaments se
chevauchent.
Les filaments de myosine se caractérisent par la présence d’un nombre important de têtes, appelé
pont d’union, environ 200 par sarcomère. C’est l’union de ces têtes et des filaments d’actines
poursuivi par le pivotement des têtes qui génère le rapprochement des extrémités du sarcomère et
donc la contraction musculaire. Au microscope, les extrémités d’un sarcomère au repos laissent
apparaître une bande claire qu’on appelle « LA BANDE I ». « La strie Z » centrale a la bande I
correspond au point d’union des deux sarcomères. « LA BANDE A » qui est centrale correspond a
l’emplacement des filaments de myosines. La « ZONE H » et la zone qui correspond a l’absence de
filament d’actine c'est-à-dire la zone de non recouvrement de ces myofilaments en absence de
contraction. Lors de la contraction il y a disparition de la « ZONE H ».
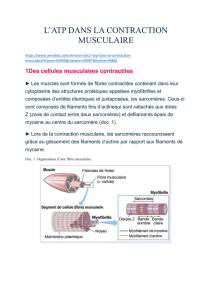
3.2 La contraction musculaire
La myosine forme avec
l’actine des ponts d’union
(têtes de myosine) qui
attirent le myofilament
épais entre les
myofilaments fins. Par
conséquent les lignes Z se
rapprochent, alors que la
zone H et la bande I se
rétrécissent ; le
déplacement lié à la
contraction résulte donc
de l’addition des
raccourcissements des
sarcomères disposés en
série dans les myofibrilles.

3.3 Mécanisme énergétique de la contraction musculaire
3.3.1 Stimulation grâce au déversement du calcium
3.3.2 Placement de la tête de myosine grâce à l’hydrolyse de l’ATP
Vue en coupe du dégagement
du site de fixation de la
myosine grâce au calcium.

3.3.3 Relâchement grâce à la présence d’une molécule d’ATP
BILAN :
La contraction musculaire est possible grâce évidemment aux différentes
structures musculaires mais aussi grâce aux molécules d’ATP qui sont
hydrolysées par une ATPase (enzyme) + Mg2+
Sans oublier le dégagement du site de fixation de la tête de myosine sur
l’actine par l’arrivée massive de calcium initiée par la commande nerveuse.
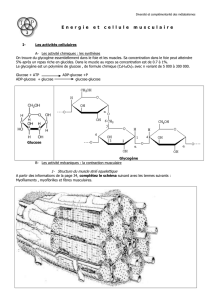
3.4 Régénération de l’ATP dans la cellule musculaire
L’ATP est régénérée par trois voies métaboliques :
1/ créatine kinase :
ADP + PC (phosphocréatine) →ATP +C (créatine)
2/ Glycolyse :
Glycogène (n Glucoses) + 3ADP+ 3Pi →2C3 H6 O3 + 3ATP+Ac.lactique
3/ Phosphorylation oxydative (respiration cellulaire) :
C3 H4 O3 (acide pyruvique) + 2O2 + 18 ADP+ 18 Pi →3 CO2 + 20 H2 0 + 18 ATP
1
/
3
100%