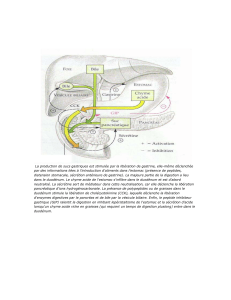
II. Rappels d`anatomie fonctionnelle du tube digestif

I. INTRODUCTION
Pour satisfaire ses besoins énergétiques et plastiques, l’homme doit absorber des aliments et les
transformer : ce sont généralement des grosses molécules qu’il faut dégrader. Cette transformation sert
à mettre les substances ingérées sous forme assimilable. Ainsi, elles pourront être utilisées pour
l’entretien des cellules pour fournir des substances constitutives ou utilisées pour produire de
l’énergie.
les fonctions digestives sont des fonctions mécaniques et chimiques.
1. la motricité digestive
c’est l’ensemble des mécanismes permettant aux aliments de franchir le tube digestif, long de 5 à 8 m.
Rôle : faire migrer les aliments du pôle oral au pôle anal
mélange du contenu digestif avec les différentes sécrétions.
élimination des substances non absorbées, des substances à éliminer (comme les stéroïdes
et beaucoup de médicaments).
2. la sécrétion
le tube digestif est l’appareil qui présente la plus grande quantité de sécrétion (en volume) de
l’organisme. Des sécrétions apparaissent aux différentes étapes de la digestion avec de
l’eau, des électrolytes, et des substances organiques (enzymes...)
3. l’absorption
C’est la finalité de la digestion. 95 à 99 % du contenu alimentaire va passer dans le milieu intérieur via
les entérocytes, pour gagner les lieux de stockage ou les sites d’utilisation.
Le tube digestif est le milieu extérieur
L’ensemble de ces fonctions est régulé par
le système nerveux
le système hormonal.

PC1 Physiologie de la digestion page 2
II. RAPPELS D’ANATOMIE FONCTIONNELLE DU TUBE DIGESTIF
A. LES PAROIS DU TUBE DIGESTIF
1. La musculature de tube digestif
a) Fibres striées
présentes au début du tube digestif et à la fin :
pôle oral : pharynx et premier tiers de l’oesophage
pôle anal : sphincter anal externe.
Elles subissent le contrôle du SNC volontaire (on contrôle nos entrées et nos sorties).
b) Fibres musculaires lisses
Elles sont partout ailleurs, sous le contrôle du SN autonome
On observe 2 couches de fibres musculaires :
couche de fibres circulaires, la plus interne, proche de la lumière
couche de fibres longitudinales, la plus externe.
A certains niveaux, on voit une modification de l’aspect de la couche interne : les fibres musculaires
circulaires augmentent de taille, s’épaississent à certains endroits et forment des sphincters. Cette zone
présente une activité tonique ; elle joue le rôle d’un clapet qui permet ou non le passage du contenu
digestif d’une cavité à l’autre.
c) Activité motrice
L’activité motrice se caractérise par des phénomènes de polarisation, dépolarisation. Les cellules des
fibres musculaires lisses présentent - comme toute cellule - une polarisation de leur membrane. Cette
polarisation est instable, comme pour les muscles striés mais la différence est que les cellules
musculaires lisses présentent des oscillations de leur valeur de repos et que chaque cellule musculaires
se polarise et se dépolarise de façon régulière et rythmique.
Des zones de contact de cellule à cellule, les nexus (zones de moindre résistance électrique) permettent
le passage des phénomènes électriques de dépolarisation.
Ces courants de dépolarisation sont de deux types :
des ondes lentes avec des dépolarisation de faible amplitude ne provoquant pas de contraction
des ondes provoquant des potentiels d’action et des contractions.
Il y a donc un seuil (- 30 mV en général), de déclenchement d’un spike : un P.A, donc une contraction
des fibres.
La fréquence des oscillations basales varie en fonction de la localisation :
duodénum : 11 cycles/mn
iléon : 9 cycles/mn.
Sous l’effet du PA, du Ca2+ entre dans la cellule et déclenche la contraction des fibres musculaire.
L’amplitude de la contraction dépend du nombre de PA qui se greffent sur l’onde lente.
Les cellules musculaires sont sensibles à l’étirement. L’étirement passif d’une fibre musculaire lisse
peut donner naissance à une décharge de PA. La fréquence de ces PA dépend de différences
d’étirement : l’amplitude de la contraction est directement proportionnelle à l’étirement.

PC1 Physiologie de la digestion page 3
Ce rythme électrique est imposé par une zone pacemaker, située du côté oral du tube digestif, puis il y
a propagation des phénomènes dans le seul sens oro-anal.
d) Variations de l’activité électrique au cours du temps :
en période interdigestive :
Chez le sujet à jeun, on observe une activité électrique et motrice : le CMM : Complexe Moteur
Migrant. Il comprend 3 phases successives :
Phase 1, de quiescence : il y a uniquement des modification de polarité membranaire sans
déclenchement de contractions.
Phase 2, irrégulière : il y a quelques PA qui se greffent sur les oscillations, on a des contractions
irrégulières, d’amplitude variable en fonction de la fréquence des PA..
Phase 3, régulière : à chaque oscillation basale se greffe un PA, on a des contractions régulières,
mais d’amplitude variable (les différences dépendent de la fréquence des PA).
L’ensemble de ces phases se succèdent en chaque point du tube digestif.
La première description date de 1969. On a longtemps pensé qu’il n’existait qu’un CMM, et que celui
de l’intestin était la suite de celui de l’estomac.
Il semble en fait qu’il y a 2 CMM, un pour l’estomac et l’autre pour l’intestin.
Le CMM gastrique débute dans le fundus et se propage en direction du pylore.
Le CMM intestinal part du bulbe duodénal et se propage jusqu’à la valvule iléo-coecale.
Le CMM dans son ensemble (estomac + intestin) dure 130 mn pour aller du pace maker au pôle anal.
Pendant qu’un complexe migrant se déroule, aucun autre ne peut démarrer.
ii En période d’absorption :
A chaque ingestion le CMM disparaît. On observe une activité électrique caractéristique de
l’absorption qui ressemble à la phase 2 : des oscillations basales et des PA qui apparaissent de façon
irrégulière, et qui persistent jusqu’au terme de la phase d’absorption.
Il y a une relation étroite entre la sécrétion de la motiline et la motricité. Quand la concentration de
cette hormone augmente, la motricité augmente. Elle agit directement sur la perméabilité des
membranes cellulaires.
Le système nerveux intervient égalemement.
2. L’innervation du tube digestif
Elle fait intervenir le système nerveux central autonome.
Elle est en grande partie sous la dépendance d’un SN intrinsèque c'est à dire contenu dans la paroi
digestive, intramural. Le SN extrinsèque, végétatif n’intervient que dans la modulation du contrôle.
Les substances qui vont intervenir :
Acétylcholine : mécanismes cholinergiques
Noradrénaline : mécanismes adrénergiques
ATP
Sérotonine (5-hydroxy-tryptamine)
Acide amino-butyrique (GABA)
VIP : Vasoactive Intestinal Peptid
somatostatine
Substance P

PC1 Physiologie de la digestion page 4
Motiline
(GIP : Gastric Inhibiting Peptid)
a) L’innervation motrice
i elle comprend 2 parties
1. partie intramurale : à l’intérieur de tube digestif : le système intrinsèque. La paroi du tube digestif
présente une innervation importante avec des plexus qui sont des amas de corps cellulaires.
Les plexus situés entre les 2 couches de fibres musculaires sont les plexus d’Auerbach.
Les plexus situés le plus près de la lumière intestinale sont les plexus de Meissner.
Ces plexus sont interconnectés et ce sont eux qui sont directement en contact avec les couches
musculaires et les innervent. C’est pourquoi quand on prélève un fragment du tube digestif, si on le
place dans un milieu de survie, il est possible d’obtenir des contractions.
2. innervation périphérique extrinsèque : elle comprend les 2 systèmes sympathique et
parasympathique originaires respectivement de la moelle épinière et du bulbe (lieu d’intégration de
la plupart des phénomènes réflexes du tube digestif).
L’innervation extrinsèque agit sur les fibres musculaires : activité directe, ou sur les plexus : activité
véhiculée.
ii Les principaux nerfs
SN parasympathique : il part du bulbe. Il passe presque en totalité par la X° paire de nerfs crâniens
: le nerf Vague = nerf pneumogastrique. Ce nerf se répartit sur presque la totalité du T.D.(seuls les
derniers cm du rectum et de l’anus sont innervés par les nerfs pelviens). Au niveau des neurones
post ganglionnaires : libération d’acétylcholine (et parfois de substances inhibitrices). L’action est
essentiellement de type stimulant sur la motricité. Son importance est très grande et la vagotomie
aura des répercussions importantes sur la motricité.
SN sympathique : les nerfs partent de la moelle dorsale font relais au niveau de ganglions :
ganglion cervical, ganglion mésentérique supérieur et mésentérique inférieur. Ils se divisent en
direction de la totalité du TD. Ce sont les nerfs splanchniques. Ils comprennent surtout des fibres
adrénergiques.
iii Cortex
Il exerce son action sur les fibres musculaires striées.
b) Innervation sensitive
elle est composée de récepteurs disséminés tout le long du TD. Il y a des thermorécepteurs, des
chémorécepteurs, et des mécanorécepteurs, sensibles à la distension. Les fibres sensitives empruntent
les voies du pneumogastrique et des nerfs splanchniques. Il y a des fibres sensitives au niveau du
plexus de Meissner (un intestin isolé peut percevoir).
c) La motricité digestive
Elle se caractérise par 2 types de contractions ayant des rôles différents :
1. contractions non propagées : ce sont des contractions de segmentation. Elles permettent le brassage
du contenu intestinal, le contact, le mélange entre sécrétions et aliments ainsi que le contact entre
nutriments et entérocytes.

PC1 Physiologie de la digestion page 5
2. contractions propagées : on parle de péristaltisme. Son rôle est le déplacement du contenu dans le
sens oro-anal.
La motricité digestive fait l’objet d’une régulation locale par le système intrinsèque qui permet la
progression du contenu.
Exemple : le passage du bol alimentaire dans l’oesophage. Le contenu alimentaire distend les fibres
musculaires qui se contractent.
en amont du bol alimentaire, il y a contraction des fibres musculaires circulaires
en aval une contraction des fibres longitudinales.
Ce mécanisme de contractions est couplé à un relaxation par inhibition des fibres circulaires en aval et
des fibres longitudinales en amont. Cela permet la progression du bol alimentaire.
l’activité contractile augmente avec l’ACh, diminue avec A.
L’atropine (anticholinergique) bloque les récepteurs à ACh.
B. LA MUQUEUSE
L’ensemble du TD présente une continuité évidente et une particularité par rapport à beaucoup
d’autres tissus : un renouvellement cellulaire important.
1. La continuité en surface
La paroi du tube digestif communique avec le milieu extérieur. Elle est faite d’un épithélium de
cellules jointives qui représentent la barrière entre la lumière digestive et le sang circulant à proximité.
La force de cohésion assurée par les desmosomes est importante et ne passent entre les cellules que de
l’eau et des petits ions.
Tout le reste doit passer à l’intérieur des cellules, sous la dépendance de mécanismes cellulaires. On
note la présence d’une vascularisation importante, très proche de la lumière.
L’épithélium a également un rôle de défense contre des agents toxiques. Il présente en effet à sa
surface des glycoprotéines formant une couche visqueuse de ½ mm d’épaisseur, le mucus. Il rend très
difficile la diffusion des grosses molécules.
2. Le renouvellement cellulaire
C’est un phénomène permanent. Il y a des zones où les cellules sont immatures (zones germinatives) :
les cellules présentent un grand nombre de divisions et selon le cheminement qu’elles auront' elles se
différencieront en cellules différentes (épithéliales, endocrines ou sécrétoires). 100 milliards de
cellules sont renouvelées chaque jour. Dans le même temps, autant sont desquamées.
L’épithélium intestinal se renouvelle entièrement tous les 3 à 5 jours.
Estomac : la vitesse de renouvellement est différente selon le type de cellules :
Cellules à mucus : 4 à 6 jours
Cellules pariétales : 20 jours
Cellules principales : 2 mois
Ce renouvellement est contrôlé par des substances stimulantes qui ont un rôle trophique. On observe
des phénomènes d’hypertrophie ou d’atrophie quand ces substances sont insuffisantes.
La gastrine, les facteurs de croissance, l’hydrocortisone et l’entéroglucagon ont un rôle trophique.
les prostaglandines freinent le renouvellement.
Les substances qui diminuent le renouvellement favorisent l’apparition d’ulcères. Les substances
dangereuses sont l’alcool et l’aspirine.
L’alcool entraîne une floculation du mucus qui prend un aspect globulaire.
cellules
sécrétoires
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
1
/
57
100%