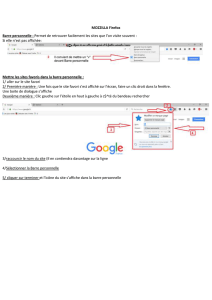
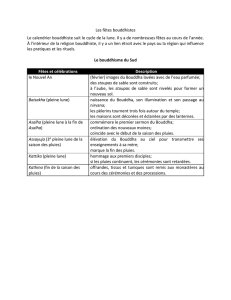
2008-2009 Sadiki

1
Collège Sadiki
Devoir de synthèse n° : 1
Sciences physiques
3 Math et Sc.Exp
Jeudi 11 -12-2008
Prof : Obey, ElFekih et Cherchari
EXERCICE 1 (3pts)
* Les fumées et les gaz émis par les voitures et les usines rendent acides la pluie, la neige et le brouillard. Des
pluies acides tombent dans des régions de presque chaque continent et abîment peu à peu notre
environnement. Les pluies acides ne sont pas un problème nouveau mais elles augmentent et s’ aggravent au
point de susciter notre inquiétude . Elles constituent depuis la révolution industrielle un des problèmes les
plus sérieux pour notre environnement.Ces pluies acides dont le pH qui est de l'ordre de 4 peut atteindre 2.
* Les feuilles des arbres tombent prématurément, leurs racines deviennent clairsemées, leur croissance est
ralentie et, la plupart du temps, ils finissent par mourir.
*Les pluies acides acidifient les lacs (le pH baisse). La faune et la flore disparaissent peu à peu : les poissons
meurent ou ne se reproduisent plus.
*Les monuments ne sont pas épargnés : le calcaire et l'acier sont attaqués et un grand nombre de monuments
sont actuellement en danger (le Parthénon à Athènes, la Tour de Londres...).
*Les pluies acides peuvent être causées par deux produits:
le monoxyde d'azote (NO)
le dioxyde de soufre (SO2)
*Le dioxyde d'azote est formé dans les moteurs à combustion des voitures. La réaction chimique entre le
dioxygène de l'air et le monoxyde d’azote a lieu à très haute température dans les moteurs des voitures
produit du dioxyde d’azote qui avec l’eau de pluie forme l’acide nitrique.
2NO + O2 Error! 2 NO2 3 NO2 + H2O Error! 2 HNO3 + NO
*Le dioxyde de soufre provient de la combustion des matériaux pour fossiles (exemples : Charbon, pétrole ….),
qui contiennent du soufre. Le dioxyde de soufre réagit avec le dioxygène de l’air pour donner le trioxyde de
soufre qui avec l’eau de pluie forme l’acide sulfurique.
2 SO2 + O2 Error! 2 SO3 SO3 + H2O Error! H2SO4
1- Qu’elle est la cause de la pluie acide ?
2- Dégager du texte les phrases qui montrent les effets indésirables des pluies acides?
3- Donner des exemples d’acides cités dans ce texte et qui peuvent exister dans les pluies acides.
4- Donner les couples acide base correspondant à ces acides puis écrire ses équations formelles.
Exercice 2 (4 pts)
On réalise dans un excès de dioxygène, la combustion complète d’un composé organique oxygéné A de
formule brute CnH2nO2 et de masse molaire M; les résultats de cette expérience ont permis de déterminer le
pourcentage massique du carbone dans ce composé : %C : 54,54 %
1°) Comment peut on montrer, à l’aide d’une combustion complète, que le composé A renferme dans sa
formule le carbone et l’hydrogène.
2°) a- Vérifier que les pourcentages en carbone, en hydrogène et en oxygène peuvent s’écrire sous la forme :
%C =Error!; %H = Error! et %O = Error!. On donne M(H) =1g.mol-1, M(C) =12g.mol-1 et M(O) =16g.mol-1.
b- Montrer que le rapport Error! = 6. Calculer les pourcentages d’hydrogène %H et d’oxygène %O.
c- A partir de l’expression du pourcentage de l’oxygène, calculer la masse molaire M du composé (A).Déduire
n.
d- Donner la formule brute du composé A.
3°) Lors de la combustion complète on a utilisé un volume V = 240 mL du composé A.
a) Ecrire l’équation de la réaction.
b) Déterminer le volume de dioxyde de carbone dégagé.
On donne : volume molaire à la température de l’expérience : VM = 24 L.mol-1
Chimie ( 7 points )

2
Exercice n° 1 ( 6 pts ) :
on donne : G=6,6710-11 usi .
Le Soleil, la Terre et la Lune sont supposés à
répartition de masse à symétrie sphérique. On se
propose d’étudier les effets des forces de
gravitation universelle FS/T et FL/T exercées
respectivement par le soleil et par la lune sur la Terre dans deux dispositions différentes comme l’indique les
figures 1 et 2. On suppose que dans les deux positions de la lune, les distances Terre-Lune et Terre-Soleil
restent les mêmes et que les actions des autres astres sur la Terre sont considérées négligeables.
Figure 1
Figure 2
1- a- Représenter, sur les deux figures 1 et 2, les vecteurs champs de gravitation universelle GS et GL créés
respectivement par le soleil et la lune au centre de la Terre.
b- Donner les expressions des vecteurs ;GS et ;GL. ( dans les figures 1 et 2)
c- Déduire l’expression de la valeur du champ de gravitation universelle créé par chaque astre
(G0T pour la Terre, G0L pour la Lune et G0S pour le soleil) en un point de sa surface.
d- Calculer ;G0T /;G 0L et ;G0S /;G 0T.
2- Calculer la valeur de chacune des deux forces FS/T et FL/T exercées respectivement par le soleil et par la
lune sur la Terre. Calculer le rapport $Error!.
3- Donner le nom du phénomène physique correspondant aux figures 1 et
2.
Exercice n° 2 ( 7 pts )
On néglige les forces de frottement et le champ magnétique terrestre.
Deux barres conductrices sont disposées parallèlement suivant la ligne de plus
grande pente d'un plan incliné d'un angle sur l'horizontale. Elles sont distantes
de L; leurs extrémités supérieures sont reliées entre elles par un générateur G et
par un interrupteur K. Une barre MN conductrice est posée
perpendiculairement sur les deux barres précédentes. Le contact électrique se fait en M et N. On crée dans la
région où se trouve la barre MN un champ magnétique uniforme
B
perpendiculaire au plan des rails. On
ferme K. Un courant d’intensité I circule dans le montage.
1- Représenter les forces exercées sur la barre MN pour qu’elle puisse
être en équilibre (on peut utiliser la vue de droite). Déduire le sens de
B
2- La barre MN a une masse m =10 g et pour qu’elle soit en équilibre il
faut que l’intensité du courant soit égale à I1=10 A.
a- Etablir la condition la condition d’équilibre de la barre MN.
u
Terre
Soleil
x
x’
v
y
Lune
Lune
u
Terre
Soleil
x
x’
Physique (13 points)
G
M
N
K
Astre
Masse (kg)
Rayon( Km)
Soleil
2x1030
1,4.109
Terre
6.1024
6,39 103
Lune
7,37×1022
1738
Distance entre les centres de gravité :
Terre-Lune : dT-L
3,8.108 m
Terre-Soleil : dT-S
1,5.1011 m
Barre MN
Vue de droite

3
b- Exprimer la norme de
B
en fonction de I1 , L, m, g et pour que la barre reste en équilibre. Montrer
que
B
=68 mT.
On donne : = 20 ° ; g=10 N/kg et L=0,05 m.
3- L’intensité du courant est I2 =15 A et on garde le champ magnétique
B
précédent, on place sous la barre MN un ressort à spires non jointives,
de raideur k de masse négligeable dont la direction est celle de la plus
grande pente du plan incliné ( voir figure ci-contre).lorsque
l’interrupteur K est ouvert la barre MN est en équilibre. On ferme
l’interrupteur K, la barre MN prend une nouvelle position d’équilibre
M’N’ telque le ressort soit allongé de l=3,36mm.
a- Représenter les forces exercées sur la barre MN(on peut utiliser la vue
de droite).
b- Etablir la condition d’équilibre de la barre. Déduire la valeur de la
constante de raideur k du ressort.
G
M
N
K
1
/
3
100%