I. Aspirine et prévention cardiovasculaire (11 points)

17/04/2017 840906869 1/3
Le 25/04/2014
Page : 1 / 3
Devoir n°6 – Correction
Tale S3
I. Aspirine et prévention cardiovasculaire (11 points)
1. Synthèse de l’aspirine
Questions :
1.1. n1 =
Error!
=
Error!
= 7,25 10-2 mol d’acide salicylique
n2 =
Error!
car la masse volumique µ2 =
Error!
soit m2 = µ2V2 ; n2 =
Error!
= 0,149 mol.
1.2. Le réactif en excès est l’anhydride éthanoïque car une mole d’anhydride éthanoïque réagit avec une mole
d’acide salicylique et n2 > n1.
1.3.
1.4. CH3COOH est la molécule d’acide éthanoïque. Sa formule développée est :
2. Dosage d’un sachet d’aspirine
2.1. Légende du matériel utilisé ainsi que la place des solutions : voir page 3.
2.2. AH(aq) + HO-(aq) = A-(aq) + H2O
2.3. Méthode des tangentes : VE = 10,7 mL ou maximum de la dérivée du pH par rapport au volume V de
solution d’hydroxyde de sodium versé.
Le pH à l’équivalence est pHE = 7,38
7,4
2.4. L’indicateur coloré qui convient est dont la zone de virage contient le pH à l’équivalence. Seul le bleu de
bromothymol convient.
2.5. A l’équivalence, les réactifs sont dans les conditions stœchiométriques (ou il ya changement de réactif
limitant). Dans ce cas n(AH (aq))0 = n(HO-(aq))E car la réaction de titrage a lieu mole à mole.
2.6. Pour le prélèvement de 100,0 mL, n(AH (aq))0 = CB VE = 1,00 10-2 10,7 10-3 = 1,07 10-4 mol
Pour la solution S de 500,0 mL, la quantité d’aspirine sera 5 fois plus importante soit nexp = 5,35 10-4 mol
La masse d’aspirine sera mexp = nexp M3 = 5,35 10-4 180 = 9,63 10-2 g = 96,3 mg.
2.7.
Error!
2 =
Error!
2 +
Error!
2 =
Error!
2 +
Error!
2 = 8,7 10-5 + 4,0 10-4 = 4,9 10-4
Soit
Error!
=
Error!
= 2,2 10-2 ; U(mexp) = 2,2 10-2 96,3 mg = 2,1 mg
mexp - U(mexp) mexp mexp + U(mexp) soit 94,2 mg mexp 98,4 mg.
2.8. L’encadrement obtenu à la question précédente n’est pas en accord avec la mention portée sur le sachet
d’aspirine qui est de 100 mg. L’écart observé peut être dû :
A une mauvaise détermination du volume équivalent (changement de coloration difficile à repérer, mauvaise
lecture sur la burette) ;
L’élève aurait dû rincer le sachet avec de l’eau distillée afin d’être certain de récupérer toute l’aspirine
solide ;
A une erreur dans le prélèvement du volume à doser ;
A la dissolution incomplète de l’aspirine dans la solution.
2.9. La forme prédominante du couple aspirine/ion acétylsalicylate dans l’estomac est l’aspirine car le pH est
inférieur au pKA donc c’est la forme acide du couple qui prédomine.
II. Le système GPS (5 points + Bonus 1 point)
1) Postulats d’Einstein :
Les lois de la physique s’expriment de la même façon dans tous les référentiels galiléens.
CC
CH
CH
CH CH
O
C
O OH
C
CH3
O
groupe ester groupe carboxyle
C C
O
O
H
H
H
H

17/04/2017 840906869 2/3
La vitesse de la lumière dans le vide, notée c, est la même dans tous les référentiels galiléens.
2) Les ondes émises sont des ondes électromagnétiques, elles se propagent à la vitesse de la lumière.
3) La distance minimale est de l’ordre de 20000km, le temps de propagation est donc :
t =
Error!
=
Error!
= 6,7 10-2 s = 67 ms.
4) A la vitesse de la lumière : d = c × t = 3,00 × 108 × 1 × 10-6 = 3 × 102 m = 300 m
5) Le temps mesuré par une horloge embarquée dans un satellite est appelé « temps propre » du satellite. Le
mouvement du satellite par rapport à la Terre est à l’origine d’une différence de temps conformément à la théorie
de la relativité restreinte. Pour un observateur terrestre, le temps mesuré par une horloge dans le satellite est plus
long que celui mesuré par une horloge terrestre qui mesure le temps propre sur Terre.
6) Le temps Δt mesuré par l’horloge du satellite à vitesse v par rapport au temps Δt0 mesuré par une horloge terrestre
est : t =
Error!
Δt0
7) t =
Error!
Δt0 = Δt0 (1 –
Error!
)-1/2 ; on pose = –
Error!
; (1+ )n ≈ 1+ n soit t
Δt0 (1 +
Error!
Error!
)
8) Avec v = 3,85 km.s-1 = 3,85 103 m.s-1, c = 3,00 × 108 m.s-1 et Δt0 = 1s, on a :
t
Δt0 (1 +
Error!
Error!
) = 1 ( 1 +
Error!
Error!
) = 1 + 8,23 10-11 s . Ainsi la durée perçue sur Terre
sera augmentée de 8,23×10-11s = 82,3 × 10-12 s
82 picosecondes, comme le dit le texte : « ce qui entraîne un
retard de 82 picosecondes par seconde ».
III. Le pendule simple (4 points)
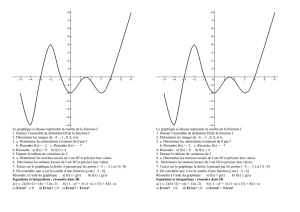
1) Représentation du pendule dans sa position à la date t = 0 s et sens de déplacement.
2) Pour l’enregistrement 1, l’amplitude des oscillations est de 15°.
Pour l’enregistrement 2, l’amplitude des oscillations est de 10°.
3) Pour 2,0 s, la mesure sur l’enregistrement 1 est de 11,2 cm
Pour 4 périodes T, la mesure sur l’enregistrement 1 est de 13 ;9 cm
Soit 4T =
Error!
d’où T =
Error!
= 0,62 s
4) La période T d’un pendule simple est indépendante de la masse m donc les relations et sont à éliminer
Il faut montrer que
Error!
est homogène à un temps. L est une longueur en m ; g est l’intensité de la pesanteur
en m.s-2 donc
Error!
est en
Error!
soit en s² donc
Error!
est bien homogène à un temps. La relation est la
bonne.
5) De T = 2
Error!
, on obtient T² = 4²
Error!
d’où L =
Error!
; L =
Error!
= 9,5 10-2 m = 9,5 cm
Enregistrement 1
Enregistrement 2

17/04/2017 840906869 3/3
I
1.1
1
2
3
4
CS-U
/33
1.2
1
1.3
1
2
3
4
1.4
1
2
2.1
1
2
3
4
2.2
1
2.3
1
2
3
2.4
1
2
2.5
1
2
2.6
1
2
3
4
CS-U
2.7
1
2
CS-U
2.8
1
2
2.9
1
2
II
1
1
2
/18
2
1
2
3
1
2
4
1
2
5
1
2
6
1
2
7
1
2
3
8
1
2
3
III
1
1
2
/12
2
1
2
3
1
2
3
CS-U
4
1
2
5
1
2
3
CS-U
TOTAL : ............ /63
NOTE : ............ /20
Burette
Solution titrante
d’hydroxyde de sodium
Bécher avec la solution
d’aspirine à titrer.
pH-mètre
Agitateur magnétique
1
/
3
100%