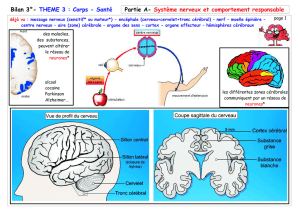
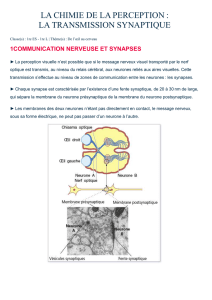
Schéma bilan synthèse protéines

1 Partie : DU GENOTYPE AU PHENOTYPE.
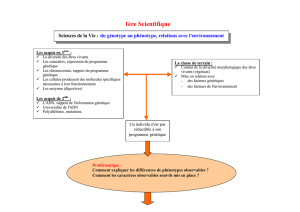
Le phénotype d’un individu désigne l’ensemble de ses caractéristiques observables au niveau
morphologique, anatomique et physiologique.
Le génotype correspond à l’ensemble des allèles que possède un individu sur ses chromosomes. Le
génotype est hérité des parents.
Le phénotype d’un individu résulte en partie de l’ensemble des informations héréditaires qu’il porte, son
génotype.
Problème : Comment passe-t-on du génotype au phénotype?
Chapitre 1 : Les différents niveaux d’analyse du phénotype
I) L’exemple de la drépanocytose
(ex. 1-3 page 17)
Le phénotype drépanocytaire peut se définir à 3 niveaux différents :
Le [macroscopique] ou [clinique] : Ce phénotype est marqué par une fatigue, des vertiges, une anémie
sévère, des douleurs aux niveaux de nombreux organes et une mauvaise circulation sanguine dans les
capillaires.
Le [Cellulaire] se traduit par des globules rouges en forme de faucilles (anémie falciforme) rigides. Ces
GR restent bloquées au niveau des capillaires et forment des bouchons.
Le [moléculaire] est lié à la présence de l’hémoglobine (Hb), protéine localisée dans le cytoplasme.
L’Hb d’un individu drépanocytaire est fibreuse, elle déforme les GR qui prennent une forme en faucille.
Le [moléculaire] impose le [cellulaire] qui impose le [macroscopique]
II) Autre exemple : la couleur de la peau
(ex. 1 page 19 Origine des phénotypes ?)
La couleur de la peu dépend de la quantité de mélanine contenue dans certaines cellules de la peau, qui
est déterminée par l’activité de certaines mollécules appellées enzymes, qui sont des protéines.
Tyrosine Mélanine
Protéine ; enzyme
tyrosinase
Phénotype [Albinos]
Le phénotype moléculaire repose toujours sur la présence de molécules de la famille des protéines. Le
[moléculaire] impose le [cellulaire] qui impose le [macroscopique]. Les protéines sont donc les
molécules clés dans l’établissement du phénotype.
Un gène, une information génétique conduit à la synthèse d’une protéine. Les protéines sont
l’expression du génotype.
Au sein d’une même espèce les différents phénotypes s’expliquent par la présence d’une grande
diversité d’allèles pour un gène donné. Un allèle est une version possible d’un gène.

Chapitre 2 : Les protéines, des molécules clés dans l’établissement du phénotype
Comment sont constituées les protéines ?
I) 1 –Composition et structure des protéines
TP n°1 : hemogloçbine 3D. Poly structure des protéines.
Les protéines sont des polymères d’acides aminés (aa), c’est à dire qu’une protéine est constituée par
un ensemble d’aa liés les un aux autres.
La technique d’électrophorèse permet de séparer ces différents aa selon leur charge électrique et leur
poids moléculaire. Cette technique a permis de mettre en évidence 20 a.a. différents au niveau des
protéines de tous les organismes vivants
Chaque aa est une molécule constituée par un groupe acide COOH et un groupe amine NH2.
Formule générale des acides aminés
NH2 : amine
COOH : acide carboxylique
H : Hydrogène
R : Région variable
Ce qui varie d’un aa à un autre est la chaîne latérale R ou région variable.
Une protéine est donc une séquence d’aa, cet enchaînement d’aa est nommé la structure primaire de la
protéine. L’enchaînement des aa de fait grâce à des liaisons peptidiques, liaison covalente entre
l’azote NH2 d’un aa et la fonction COOH de l’aa suivant. Lors de cette liaison une molécule d’eau est
libéré
Il existe 20 aa différents, mais des milliards de combinaisons, de séquences possibles et donc autant de
protéines différentes.
Lorsque la chaîne est constituée de 2 aa, on parle de dipeptide. Le terme de polypeptide est utilisé pour
désigner les protéines formées d’une seule chaîne ; ainsi l’hémoglobine est une protéine constituée de 4
chaînes polypeptidiques (4 polypeptides).
Cette séquence d’aa ne va pas conserver sa structure primaire et rapidement la protéine va prendre dans
l’espace une forme spécifique, on parle de conformation tridimensionnelle où structure tertiaire
d’une protéine.
Cette structure tridimensionnelle s’obtient par des liaisons non peptidiques entre différents aa non
contigus c.a.d éloignés les uns des autres..
Il existe 2 types de liaisons non peptidiques possibles dans une protéine :
des liaisons faibles, liaisons hydrogènes entre des aa non contigus
des liaisons covalentes comme les ponts disulfures entre des aa avec du soufre comme des cystéines.
(page 27 ex.2) La structure spatiale appelée ainsi structure tertiaire conditionne le fonctionnement de
la protéine. La modification de la structure tertiaire d’une protéine peut conduire à la modification de
sa fonction (perte, diminution ,augmentation ou apparition d’une nouvelle fonction).
(De quoi dépend la structure tertiare page 17 ou molec 3D) C’est la séquence, la structure primaire
d’une protéine qui impose par le jeu des liaisons non peptidiques, la forme spatiale cad la structure
tertiaire donc la fonction d’une protéine.

Si on change un seul aa de place dans la structure primaire on peut modifier les liaisons non peptidiques
qui s’établissent et donc modifier la forme, la fonction de la protéine.
Exemple : Dans le cas de la chaîne B de l’hémoglobine, la séquence des aa de cette protéine est
différente pour un individu sain et un individu atteint de la drépanocytose (aa n°6 glu→val). La forme
de l’hémoglobine est différente est conduit au phénotype malade.
(page 37 ex.3)
Les protéines sont des macromolécules responsables de la construction, de l’entretien et du
fonctionnement d’un organisme.
L’expression des protéines conduit au phénotype d’un organisme.
Les protéines assurent de très nombreuses fonctions dans l’organisme :
Fonction enzymatique (enzymes digestives)
Fonction de soutien (collagène, tubuline)
Fonction de mouvement (protéines du muscle)
Fonction de communication (les hormones)
Fonction de défense immunitaire (immunoglobulines=anticorps)
Fonction d’intégration du système nerveux (peptides du cerveau)…

Problèmes :Comment les protéines contribuent-elles à la réalisation du phénotype ?
II) Les enzymes, des protéines actives dans le fonctionnement cellulaire
Les protéines sont les molécules responsables des phénotypes moléculaires. Elles sont l’expression du
programme génétique.
Parmi la grande diversité des protéines d’un organisme, les enzymes sont des protéines qui jouent des
rôles importants dans le fonctionnement cellulaire et donc au niveau du phénotype cellulaire.
Problèmes : Quelles sont les propriétés des enzymes qui expliquent leur omniprésence dans les réactions
chimiques des organismes vivants ?
1) Les enzymes, des biocatalyseurs efficaces
TP n°2 : Catalyse de l’amidon COMPARAISON CATALYSE ACIDE-ENZYMATIQUE ET
SANS CATALISEUR
Ou (page 20-21) Justifier l’affirmation Les enzymes sont des catalysseurs biologiques efficaces »
Une catalyse correspond à l’accélération d’une réaction chimique par la présence d’une substance, le
catalyseur, qui reste inchangé à la fin de la réaction.
Les enzymes sont des catalyseurs biologiques ou biocatalyseurs qui réalisent toutes les réactions
chimiques nécessaires à la vie cellulaire. Elles participent activement au phénotype cellulaire.
Les enzymes sont des molécules clés du fonctionnement cellulaire elles assurent les réactions chimiques
de dégradation (catabolisme) comme les réactions de synthèse (anabolisme) nécessaires à la vie
d’une cellule.
Les molécules sur lesquelles agit l’enzyme sont appelés substrats.
Les molécules résultantes de l’action de l’enzyme sont les produits.
Conclusion : Les enzymes sont des biocatalyseurs qui rendent possible des réactions chimiques qui
seraient en leur absence impossibles. Les enzymes agissent rapidement , à faible concentration et dans
des conditions compatibles avec la vie.
Remarque : Les enzymes sont des protéines, conséquence toutes les réactions chimiques de la
cellule dépendent directement de l’équipement génétique de la cellule.

2) Les propriétés des enzymes
a ) La double spécificité
(poly spécificité substrat et action)
Une enzyme à une spécificité de substrat. Elle agit et transforme un seul type de substrat. Une enzyme
à une spécificité d’action. Elle catalyse un seul type de réaction.
b ) La vitesse d’une réaction enzymatique
V =Quantité de produit / unité de temps
TP n°3 : vitesse-substrat (ATTENTION mettre des concentration d’enzyme très faibles)
La vitesse initiale de la réaction (Vi) augmente avec l’augmentation de la concentration en substrat
disponible. A partir d’une certaine concentration de substrat, la Vi atteint un plafond et n’augmente plus
avec l’augmentation de la concentration en substrat, c’est la vitesse initiale maximal,, ou Vmax.
Si la concentration d’enzyme est plus élevée la Vmax est aussi plus élevée.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
1
/
44
100%