a- la chimie, science de la transformation de la matiere

CLASSE DE TROISIEME
Légende des couleurs : S’informer Réaliser Raisonner Communiquer Savoir
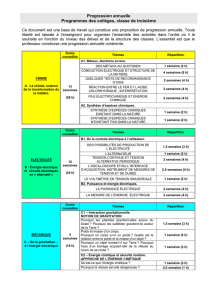
A- LA CHIMIE, SCIENCE DE LA TRANSFORMATION DE LA MATIERE
A.1 Conduction électrique
A1.1 – Conduction électrique et structure de la matière
UTILISATION DES METAUX DANS LA VIE QUOTIDIENNE : Quels sont les métaux les plus couramment utilisés ?
Je sais que :
Les métaux les plus couramment utilisés sont le fer, le zinc, l’aluminium, le cuivre, l’argent et l’or.
Je suis capable de :
Distinguer quelques métaux usuels.
Repérer quelques unes de leurs utilisations par observation et à partir d’informations.
L’ELECTRON ET LA CONDUCTION ELECTRIQUE DANS LES SOLIDES : Tous les solides conduisent-ils le courant
électrique ?
Je sais que :
Tous les métaux conduisent le courant électrique.
Tous les solides ne conduisent pas le courant électrique.
La conduction électrique dans les métaux est due à un déplacement d’électrons.
Je suis capable de :
Pratiquer une démarche expérimentale afin de comparer le caractère conducteur de différents solides.
Valider ou invalider une hypothèse sur le caractère conducteur ou isolant d’un solide.
L’ION ET LA CONDUCTION ELECTRIQUE DANS LES SOLUTIONS AQUEUSES : Toutes les solutions conduisent-elles le
courant électrique ?
Je sais que :
Toutes les solutions aqueuses ne sont pas conductrices.
La conduction électrique dans les solutions aqueuses est due à un déplacement d’ions.
La matière a une structure lacunaire.
L’atome est constitué d’un noyau et d’électrons.
Les atomes et les molécules sont électriquement neutres.
L’électron et les ions sont chargés électriquement.
Les électrons dans un métal se déplacent dans.
Le courant électrique est dû à :
- un déplacement d’électrons dans le sens opposé au sens conventionnel du courant dans un métal
- des déplacements d’ions dans une solution aqueuse.
Je suis capable de :
Comparer le caractère conducteur de l’eau et de diverses solutions aqueuses par une démarche expérimentale.
Valider ou d’invalider une hypothèse sur le caractère conducteur ou isolant d’une solution aqueuse.
Extraire d’un document les informations relatives aux dimensions de l’atome et du noyau.
Observer, recenser des informations à partir d’une expérience de migration d’ions.
A1.2 – Quelques tests de reconnaissance d’ions.
TESTS DE RECONNAISSANCE DE QUELQUES IONS : Comment reconnaître la présence de certains ions en solution ?
Je sais :
Les formules des ions Na +, Cl -, Cu 2+, Fe 2+ et Fe 3+.
Qu’une solution aqueuse peut être acide, basique ou neutre et les domaines de valeur du pH.
Qu’une solution acide contient plus d’ions H + que d’ions HO –.
Qu’une solution basique contient plus d’ions HO - que d’ions H +
Qu’une solution neutre contient autant d’ions H + que d’ions HO –
Que les produits acides ou basiques concentrés présentent des dangers


Je suis capable de :
Suivre un protocole expérimental :
- afin de reconnaître la présence de certains ions en solution
- afin de distinguer les solutions acides, basiques ou neutres
Faire un schéma de ces expériences
Décrire le comportement du pH quand on dilue une solution acide
Identifier les risques des acides et des bases et de respecter les règles de sécurité
A1.3 – Réaction entre le fer et l’acide chlorhydrique ; interprétation
REACTION ENTRE L’ACIDE CHLORHYDRIQUE ET LE FER : quels produits sont formés ?
Je sais que :
Les ions hydrogène et chlorure sont présents dans une solution d’acide chlorhydrique
Le fer réagit avec l’acide chlorhydrique avec formation de dihydrogène et d’ions fer II.
Il s’agit d’une transformation chimique car des réactifs disparaissent et des produits apparaissent.
Je suis capable de :
Suivre un protocole et faire un schéma pour :
- reconnaître la présence des ions chlorure et hydrogène
- réaliser la réaction entre le fer et l’acide chlorhydrique et mettre en évidence les produits.
- faire un schéma de l’expérience
A1.4 – Pile électrochimique et énergie chimique
APPROCHE DE L’ENERGIE CHIMIQUE : comment une pile électrochimique peut-elle être une source d’énergie ?
Je sais que :
La pile est un réservoir d’énergie chimique
Lorsque la pile fonctionne, une partie de cette énergie est transférée sous d’autres formes
L’énergie mise en jeu dans une pile provient d’une réaction chimique.
La consommation de réactifs entraîne l’usure de la pile.
Je suis capable de :
Réaliser la réaction entre une solution de sulfate de cuivre et de poudre de zinc :
- par contact direct
- en réalisant une pile
Décrire et schématiser cette réaction.
A2 – SYNTHESE D’ESPECES CHIMIQUES
SYNTHESE D’UNE ESPECE CHIMIQUE EXISTANT DANS LA NATURE : comment synthétiser l’arôme de banane ?
Je sais que :
Il est possible de réaliser la synthèse d’espèces chimiques déjà existantes dans la nature
Je suis capable de :
Suivre un protocole simple de la synthèse de l’acétate d’isoamyle.
Identifier les risques correspondants et de respecter les règles de sécurité
CREATION D’UNE ESPECE CHIMIQUE N’EXISTANT PAS DANS LA NATURE : comment créer de nouvelles espèces
chimiques ?
Je sais que :
Il est possible de réaliser la synthèse d’espèces chimiques n’existant pas dans la nature.
Le nylon® comme les matières plastiques sont constituées de macromolécules.
Je suis capable de :
Suivre un protocole simple de la synthèse du nylon ou d’un savon.
Identifier les risques correspondants et respecter les règles de sécurité

B – ENERGIE ELECTRIQUE ET CIRCUITS ELECTRIQUES « EN ALTERNATIF »
B.1 – De la centrale électrique à l’alternateur
DES POSSIBILITES DE PRODUCTION DE L’ELECTRICITE : quel est le point commun des différentes centrales
électriques ?
Je sais que :
L'alternateur est la partie commune à toutes les centrales
L'alternateur est un convertisseur d'énergie mécanique en énergie électrique
Des sources d'énergie sont renouvelables, d'autres non
Je suis capable de :
Réaliser un montage permettant d'allumer une lampe ou de faire tourner un moteur à l'aide d'un alternateur
Construire un diagramme traduisant les conversions d’énergie dans un alternateur.
Extraire d'un document les informations relatives aux sources d'énergie.
L’ALTERNATEUR : comment produire une tension alternative dans le temps ?
Je sais que :
Un alternateur produit une tension variable dans le temps.
Le déplacement d'un aimant devant une bobine produit une tension variable dans le temps.
Je suis capable de :
Produire expérimentalement une tension à l’aide d’un aimant et d’une bobine
TENSION CONTINUE ET TENSION ALTERNATIVE PERIODIQUE : qu’est-ce qui distingue la tension fournie par le secteur
de celle fournie par une pile ?
Je sais :
Ce qu’est une tension continue, variable, alternative, périodique
Ce qu'est la période d’une tension.
Ce que sont les valeurs maximale et minimale d'une tension
Je suis capable de :
Construire le graphique représentant les variations d'une tension au cours du temps
Analyser ce graphique en vue de :
- Décrire l’évolution de la tension en fonction du temps
- Reconnaître une tension alternative périodique
- Déterminer la période
- Déterminer la valeur maximale de la tension
Utiliser un tableur pour traiter ces informations
L’OSCILLOSCOPE ET/OU L’INTERFACE D’ACQUISITION, INSTRUMENT DE MESURES DE TENSION ET DE DUREE : que
signifient les courbes affichées par un oscilloscope ou sur l’écran de l’ordinateur ?
Je connais :
La fréquence d’une tension périodique et son unité dans le système international l’hertz (Hz)
La relation entre la période et la fréquence d’une tension.
La tension du secteur, alternative et sinusoïdale et sa fréquence en France égale à 50 Hz.
Je suis capable de :
Régler l’oscilloscope afin d’obtenir les meilleures conditions de mesures.
Analyser un oscillogramme en vue de :
- Reconnaître une tension alternative périodique
- Déterminer la période
- Déterminer la valeur maximale de la tension.
MESURE D’UNE TENSION : qu’indique un voltmètre utilisé en « alternatif » ?
Je sais que :
Le voltmètre en mode alternatif mesure la valeur efficace d'une tension sinusoïdale.
La valeur efficace de la tension alternative est proportionnelle à la valeur maximale.

Je suis capable de :
Reconnaître la valeur efficace de la tension indiquée sur un appareil.
Mesurer la valeur efficace d'une tension.
B.2 – Puissance et énergie électriques
LA PUISSANCE ELECTRIQUE : que signifie la valeur exprimée en watts (W), indiquée sur chaque appareil électrique ?
Je sais que :
La valeur en watt indiquée sur un appareil est la puissance nominale.
Le watt est l’unité de puissance du Système International.
Les puissances électriques domestiques ont des ordres de grandeur différents que je connais.
P=U x I pour une résistance (U et I sont les valeurs efficaces)
Pour des raisons de sécurité, l’intensité dans un fil est limitée.
Le rôle d'un coupe-circuit est de protéger les installations électriques.
Je suis capable de :
Calculer, utiliser la formule P = U x I
Identifier P, U et I sur les câbles et les prises électriques
LA MESURE DE L’ENERGIE ELECTRIQUE : à quoi sert un compteur électrique ? Que nous apprend une facture
d’électricité ?
Je sais que :
L’énergie électrique E transférée pendant une durée t à un appareil de puissance nominale P est donnée par la relation :
E=P x t
Le joule est l'unité d'énergie du Système international
Je suis capable de :
Calculer, utiliser la formule E = P x t
C – DE LA GRAVITATION ... A L’ENERGIE MECANIQUE ;
NOTION de GRAVITATION : pourquoi les planètes gravitent-elles autour du Soleil et les satellites autour de la
Terre ?
Je sais que :
Il existe une action attractive à distance exercée par
- le Soleil sur chaque planète,
- par une planète sur un objet proche d’elle,
- par un objet sur un autre objet, du fait de leur masse.
Cette action est appelée la gravitation.
La gravitation est une interaction attractive existant entre deux objets qui ont une masse.
La gravitation dépend de la distance qui sépare les objets.
La gravitation gouverne tout l’Univers.
Je suis capable de :
Présenter brièvement le système solaire.
Comparer, en listant les analogies et les différences, le mouvement d’une fronde avec celui d’une planète autour du Soleil.
POIDS et MASSE d’un corps : Pourquoi un corps a-t-il un poids ? Quelle est la relation entre le poids et la masse
d’un objet ?
Je sais que :
Le poids d’un corps est l’action à distance exercée par la Terre sur un objet situé dans son voisinage.
Le poids P et la masse m d’un corps sont deux grandeurs différentes, qui sont proportionnelles entre elles.
L’unité du poids est le newton de symbole N.
La relation de proportionnalité entre P et m s’écrit P = m
g
Je suis capable de :
Pratiquer une démarche expérimentale pour établir la relation de proportionnalité entre le poids et la masse.
 6
6
1
/
6
100%