Les diamants

Les diamants
Le diamant est un minéral composé de carbone, dont il représente l'allotrope de haute pression, qui cristallise
dans le système cristallin cubique. C’est le plus dur (dureté Mohs de 10) de tous les matériaux naturels.
Ethymologie : Le mot est dérivé du grec αδαμας (adamas : « indomptable », d'adamastos : « inflexible,
inébranlable », qui a également donné « adamantin » et « adamant », ancien nom du diamant), qui désignait
initialement le métal le plus dur
Histoire [modifier]
La découverte en 1793 de sa composition, du carbone pur, par Antoine Lavoisier, a marqué le début de
l’épopée de sa synthèse. Cependant, il a fallu attendre le milieu du XXe siècle pour qu’enfin des chimistes
réussissent à le fabriquer. Dès lors, le diamant est devenu un matériau industriel dont la production annuelle
atteint aujourd’hui plus de 400 millions de carats, soit 80 tonnes.
Propriétés : Le diamant est une forme métastable du carbone dans les conditions de température et de
pression normales. Il brûle dès 500°C dans un courant d’air, mais s’il est maintenu à 1 100°C sous atmosphère
neutre, il se transforme en graphite.
Structure cristalline : Dans son état naturel, le diamant possède une structure dérivée de la structure cubique
à faces centrées, appelée structure type diamant où en plus des atomes au coins du cube et au centre de chaque
face, quatre des huit sites tétraédrique sont occupés, ce qui donne finalement huit atomes par maille
élémentaire (contre 4 pour une structure cfc classique), et fait que chaque atome de carbone a quatre voisins.
Propriétés physiques : Sa masse molaire est de 12,02 g·mol-1, sa masse volumique mesurée est de 3 520
kg/m3.
Dans l’édifice cristallin du diamant, les liaisons entre atomes de carbones résultent de la mise en commun des
électrons de la couche périphérique afin de former des couches saturées. Chaque atome de carbone est ainsi
associé de façon tétraédrique à ses quatre voisins les plus proches (hybridation sp3 du carbone), et complète
ainsi sa couche extérieure. Ces liaisons covalentes, fortes et donc difficiles à casser, couvrent tout le
cristal, d’où son incroyable dureté.
La conductivité électrique est basse, car les électrons ne se regroupent pas comme dans un métal : ils restent
liés aux atomes et ne peuvent pas, par exemple sous l’action d’un champ électrique extérieur, former un nuage
électronique qui transporterait le courant de façon continue. En d’autres termes, le diamant est un très bon
isolant. Néanmoins, il fait l’objet d’études en tant que semi-conducteur à large bande pour l’électronique de
puissance.
La conductivité thermique du diamant est exceptionnelle, ce qui explique pourquoi il paraît si froid au
toucher. Ce minéral est, de loin, le meilleur conducteur connu de la chaleur. Dans un cristal isolant électrique
comme le diamant, la conductivité thermique est assurée par les vibrations cohérentes des atomes du réseau
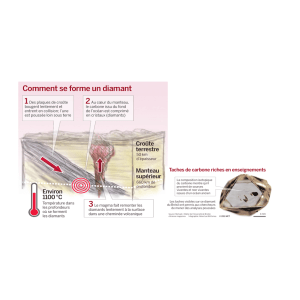
Formation : Les diamants sont constitués de carbone. Ils se forment lorsque ce dernier se trouve dans des
conditions de température et de pression très élevées, entre 1 100 °C et 1 400 °C pour la température, et entre
4,5 GPa et 6 GPa pour la pression, ce qui correspond à des profondeurs d'environ 180 km dans le manteau
terrestre. Les impuretés telles que l'azote, le soufre ou des métaux peuvent colorer le diamant.
Les diamants naturels sont composés de carbone qui se trouvait dans le manteau depuis la formation de la
Terre, mais certains sont constitués de carbone provenant d'organismes, tels que des algues. C'est ce que
révèle la composition isotopique du carbone [1]. Ce carbone organique a été enfoui jusqu'au manteau terrestre
par le mouvement des plaques tectoniques, dans les zones de subduction.
La nature minéralogique des inclusions, leur contenu en élement trace et la composition isotopique (Carbone
et Azote) des diamants eux-mêmes sont de précieux indices pour comprendre la genèse de ce minéral. Tout
porte à croire que la croissance des diamants dans le manteau lithosphérique ne résulte pas d'une
transformation directe à partir du graphite mais impliquerait plutôt l'entremise d'un fluide COH (fluide aqueux
contenant du carbone dans une forme moléculaire non spécifiée : CH4, CO, CO2) ou d'un magma carbonaté
(carbonatite). Le mode de cristallisation des diamants issus du manteau inférieur est bien moins contraint. Les
caractéristiques en éléments en traces des inclusions de pérovskites calciques dans ces diamants suggèrent à
certains auteurs une croissance associée à la présence de croûte océanique, dans une zone du manteau où elle
pourrait effectivement s'accumule

Remontée en surface : Les diamants d'Afrique du Sud ont été remontés par des éruptions volcaniques très
puissantes. Elles ont occasionné la formation de brèches volcaniques, constituées de débris de roches à
l'origine très profondes. Les diamants sont ainsi retrouvés en inclusion dans ces roches appelées kimberlites.
L'érosion peut ensuite les transporter et les incorporer dans des sédiments alluviaux.
Gisements : La plupart des diamants sont extraits de la kimberlite présente dans les zones les plus anciennes
de croûte continentale (au moins 1,5 milliard d'années)[3]. Voir craton.
Jusqu'au XVIe siècle, l'Inde et plus particulièrement la région de Golkonda (Golconde) était la seule zone de
production de diamants au monde, avec la région de Bornéo. C'est en Inde qu'ont été extraits les plus célèbres
diamants anciens. Puis les gisements du Brésil ont été découverts. Ils ont alimenté le marché occidental
jusqu'à la fin du XIXe siècle, date de la découverte des gisements sud-africains.
Depuis cette date, la plupart des diamants viennent d'Afrique (62,1 % en 1999). Cette situation a été l'origine
de plusieurs guerres comme celle du Sierra Leone, où les objectifs stratégiques étaient le contrôle des
principaux gisements du pays pour financer le conflit.
Dans les parties les plus internes des chaînes de collision tel que les Alpes, l'Himalaya ou la chaîne
Hercynienne, on trouve des roches continentales contenant des microdiamants [4]. Ces diamants se forment
au cours du métamorphisme dit de ultra haute pression en contexte subduction-collision : températures
modérées de l'ordre de 800-900°C et pression de l'ordre de 4GPa. Les diamants obtenus sont de taille
micrométrique et ne peuvent donc pas être concernés par l'exploitation minière. Cependant, ils offrent des
objets uniques pour l'étude du comportement d'un système rocheux en profondeur.
Pays producteurs : En 2005, la production mondiale de diamants était de 173,5 millions de carats et les
quatre principaux producteurs sont la Russie, le Botswana, l'Australie et la République démocratique du
Congo qui produisent à eux quatre un peu plus de 73 % de la production mondiale
Exploitation minière : Le processus d'extraction est très diversifié, puisqu'il dépend de la région dans
laquelle le diamant est exploité. Mais, en général, les opérations se divisent en trois parties :
- l'élimination des éléments stériles (terre et pierre qui couvre le sable diamantifère) ;
- l'extraction ;
- le lavage.
Du fait du coût de l'exploitation des mines (dix tonnes de minerai permettent d'extraire seulement un carat de
diamant), seules les entreprises investissent dans ces zones qui leur garantissent une production importante :
généralement, des kilomètres carrés de terrain sont excavés pour obtenir une gemme de taille appréciable, d'où
le coût des diamants.
Diamants de synthèse : Depuis que l'on sait que le diamant n'est qu'une forme particulière du carbone, les
physiciens et chimistes ont essayé de le synthétiser. La première synthèse artificielle du diamant eut lieu en
1953 à Stockholm par l'inventeur Baltzar von Platen et le jeune ingénieur civil Anders Kämpe travaillant dans
la compagnie suédoise ASEA.
En soumettant le carbone à une forte pression et à une haute température pendant plusieurs heures, il est
possible de réaliser un diamant de synthèse. Mais en raison de leur petite taille, ces derniers ne sont utilisés
que dans l'industrie.
Utilisation : Outre la joaillerie, le diamant est utilisé dans l'industrie en raison de ses propriétés, notamment
de dureté.
Cette dureté intervient aussi dans la précision que l’on peut atteindre avec des outils en diamant. Notamment,
les scalpels en diamant, permettent de créer des incisions ultraprécises (en ophtalmologie par exemple), car le
moindre effleurement découpe la peau. N'étant par ailleurs pas réactif, il est biocompatible et ne génère pas de
rejet ou de toxicité.
La chimie s’intéresse aussi fortement au diamant : il possède des propriétés qui le rendent tout à fait approprié
pour des applications en électrochimie. D’une part, il est résistant aux acides et aux bases, ce qui permet une
utilisation dans des milieux corrosifs. D’autre part, les électrodes de diamant plongées dans de l’eau pure ne
subissent aucune réaction électrochimique ; elles sont donc très efficaces.
De nombreux dispositifs optiques utilisent la transparence du diamant, tandis que les dispositifs électroniques
exploitent notamment ses propriétés thermiques.
1
/
2
100%