eau de la Manche par une méthode de dosage

Martine Rose - Lycée Maupassant - Fécamp - GRP 2013
Déterminer la salinité d’un échantillon d’’eau de la Manche par une méthode de dosage par titrage
COMPÉTENCES TRAVAILLÉES
Auto
Analyser : proposer une démarche.
Réaliser : mettre en œuvre la stratégie et le protocole
Le Gulf Stream, « le plus grand fleuve de la mer » comme l’appelait Jules Verne pourrait être ralenti à
cause du réchauffement climatique…Justifier en quoi il est important de connaître la valeur de la salinité
des océans à tout moment.
Thème : l’eau
Domaine : eau et environnement
Mots clés : mers, océans, climat
La salinité de l’eau de mer
Objectifs
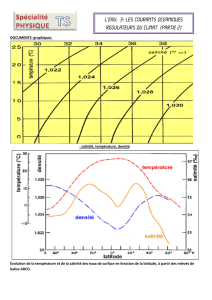
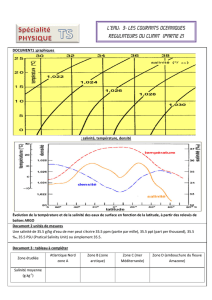
La mesure de la salinité pour étudier les courants
Pour mieux établir une carte des courants, les chercheurs utilisent des mesures
de salinité !
La densité de l'eau de mer dépend de sa température et de sa salinité, c'est-à-dire de
sa concentration en sels dissous.
Dans l'Arctique, l'eau qui gèle pour former la banquise contribue à augmenter la salinité
de l’océan. Les eaux liquides de surface sont alors froides et chargées en sel : leur
densité est élevée. Elles plongent alors en profondeur et sont entraînées vers le sud.
Sous les Tropiques, la température de ces eaux augmente : elles remontent à la
surface. Ce phénomène crée un vaste courant appelé circulation thermohaline
(thermo : chaleur et alos : sel) qui joue un rôle important dans la régulation du climat.
Au large du Groenland, des instruments permettent d'étudier les courants marins et
leurs variations, grâce notamment à des mesures de température et de salinité
Gulf Stream et salinité

Martine Rose - Lycée Maupassant - Fécamp - GRP 2013
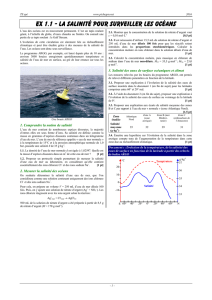
Document 1 : principaux ions contenus dans l’eau des océans
Document 2 : Salinité, chlorinité et densité
La salinité (S), (en g.kg-1), est la masse en grammes de résidu solide contenu dans un
kilogramme d’eau de mer quand tous les carbonates sont transformés en oxydes, et les
ions bromure et iodure remplacés par leur équivalent chlorure.
La chlorinité (Ch), (en g.kg-1), est la masse en gramme des ions chlorure contenus
dans un kilogramme d'eau de mer dans lequel les ions bromure et iodure sont
remplacés par leur équivalent chlorure.
La salinité d’une eau de mer normale (à 15°C et sous pression atmosphérique normale)
est de 35 g.kg-1 et sa densité est de 1,02597
Document 3 : Des techniques de mesure
Document 4 : Les salinomètres, jusqu’à 8 mesures de salinité par
seconde !
Depuis 1981, la détermination de la salinité se fait par mesure de conductivité de l'eau
de mer à partir de la définition suivante : « La salinité d'un échantillon d'eau de mer est
définie en fonction du rapport K de la conductivité électrique de cet échantillon d'eau de
mer à 15 °C et à la pression atmosphérique normale à celle d'une solution de chlorure
de potassium de référence dont la concentration molaire est C = 4,48 10-1 mol.L-1
S = 0,0080 – 0,1692 K 1/2 + 25,3853 K + 14,0941 K 3/2 -7,0261 K 2 + 2,7081 K 5/2
Le laboratoire dispose d’un seul conductimètre adapté à la mesure de la
conductivité directe de l’échantillon d’eau de la Manche prélevé sur les côtes
Anions
Chlorure
)aq(
Cl
18,98
1
g.kg
Sulfate
2)aq(4
SO
2,65
1
g.kg
Hydrogénocarbonate
)aq(3
HCO
0,14
1
g.kg
Bromure
)aq(
Br
0,065
1
g.kg
Cations
Sodium
)aq(
Na
10,56
1
g.kg
Magnésium
2)aq(
Mg
1,27
1
g.kg
Calcium
2)aq(
Ca
0,40
1
g.kg
Potassium
)aq(
K
0,38
1
g.kg
Problème :
Comment déterminer la salinité d’un échantillon d’eau de mer ?
La détermination de la salinité est délicate et a donc conduit Dittmar (fin XIXème), après avoir prélevé 77
échantillons d’eau de mer (dans toutes les mers du globe – expédition scientifique du Challenger), à énoncer
« Dans l’eau de mer, quelle que soit la salinité, à condition qu’elle ne soit pas trop faible, les proportions relatives
des principaux constituants sont pratiquement constantes et le dosage de l’un d’eux donne la teneur des autres
ainsi que la salinité ».
Début XXème, Knudsen met au point une méthode chimique pour mesurer la salinité par le biais de la chlorinité et
lie ces deux grandeurs par la relation : S =1,806655 Ch.
Différentes techniques de dosage peuvent être alors développées compte tenu de la réactivité de l’ion chlorure
avec les ions argent et du caractère conducteur de cet électrolyte qu’est l’eau de mer.

Martine Rose - Lycée Maupassant - Fécamp - GRP 2013
normandes (avec autorisation).
Matériel à disposition :
- burette
- conductimètre utilisable pour des solutions de concentration en soluté : c < 1.10-2 mol.L-1
- erlenmeyer
- pipette jaugée 10,0 mL
- fiole jaugée 100,0 mL
- béchers
Produits à disposition selon la méthode dosage utilisée :
- Solution de chromate de potassium (précipité rouge en présence d’ions argent - sert d’indicateur de fin
de réaction)
- eau de mer à diluer
- solutions de nitrate d’argent de concentration c= 5,0.10-2 mol.L-1 et c =5,0.10-3 mol.L-1
1
/
3
100%