1 - Enseignons.be

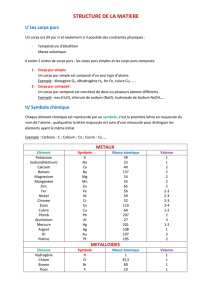
1.1. Étude du fer et du soufre
Dans deux verres de montre distincts, versons un peu de fleur de soufre et un
peu de limaille de fer. Livrons-nous à des expériences similaires sur ces deux
substances et consignons les résultats de nos observations.
Expérience 1
Fer
Versons un peu de limaille de fer dans
un verre contenant de l'eau. Agitons
Nous constatons que la limaille se
dépose au fond du verre. Le fer est
insoluble dans l'eau.
Soufre
Versons un peu de fleur de soufre dans
un verre contenant de l'eau. Agitons.
La fleur de soufre flotte sur l'eau. Le
soufre est insoluble dans l'eau.

Expérience 2
Fer
Versons quelques millilitres de sulfure
de carbone dans un tube à essais.
Ajoutons de la limaille de fer. Agitons.
La limaille de fer se dépose au fond de
l'éprouvette. Le fer est insoluble dans
le sulfure de carbone. Ces deux
constituants (le fer et le sulfure de
carbone), facilement distincts, forment
un mélange hétérogène.
Soufre
Versons quelques millilitres de sulfure
de carbone dans un tube à essais.
Ajoutons de la limaille de fer. Agitons.
La fleur de soufre disparaît dans le
sulfure de carbone. Le soufre est
soluble dans le sulfure de carbone. Ces
deux constituants (le soufre et le
sulfure de carbone), non distincts,
forment un mélange homogène.

Expérience 3
Fer
Versons un peu de limaille de fer dans un
verre de montre. Approchons un aimant.
La limaille de fer est attirée par l'aimant.
Le fer possède des propriétés
magnétiques.
Soufre
Versons un peu de fleur de soufre dans
un verre de montre. Approchons un
aimant.
La fleur de soufre n'est pas attirée par
l'aimant. Le soufre n'a pas de propriétés
magnétiques.
Après la réalisation de ces trois expériences, réfléchissons aux méthodes que
nous pouvons employer pour séparer les constituants d'un mélange fer-soufre
Reprenons la première expérience. Nous savons que ni le fer ni le soufre ne sont
solubles dans l'eau. La limaille de fer coule au fond du verre, la fleur de soufre
flotte à la surface de l'eau. Nous basant sur cette différence de comportement,
nous pouvons à bon droit émettre l'hypothèse que nous pouvons séparer les
constituants d'un mélange fer-soufre par flottation et décantation.

Confrontons notre hypothèse à la réalité grâce à une expérience: dans un verre
versons notre mélange fer-soufre (figure a). Versons ensuite de l'eau et agitons
grâce à un agitateur en verre (figure b)
figure a figure b figure c
Laissons reposer quelques instants. Nous constatons (figure c) que la fleur de
soufre flotte à la surface de l'eau (flottation) et que la limaille de fer tombe au
fond du verre (décantation).
Nous basant sur la deuxième expérience (le soufre est soluble dans le sulfure de
carbone à l'inverse du fer qui est lui insoluble dans le sulfure de carbone), nous
pouvons valablement postuler que nous pouvons séparer les constituants d'un
mélange fer-soufre grâce à la succession des opérations suivantes:
a. dissolution de la fleur de soufre dans le sulfure de carbone;
b. filtration du mélange obtenu afin de récupérer la limaille de fer, insoluble
dans le sulfure de carbone;
c. évaporation du sulfure de carbone (solvant) pour récupérer la fleur de
soufre (soluté) qui cristallise.

Portons maintenant notre attention sur la troisième expérience (le fer possède
des propriétés magnétiques alors que le soufre n'en a pas). Nous sommes
naturellement portés à penser que nous pouvons séparer les constituants d'un
mélange fer-soufre par aimantation. Une rapide expérience nous convainc de la
validité de notre hypothèse.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
1
/
120
100%