Quels tests en pré-opératoire

1
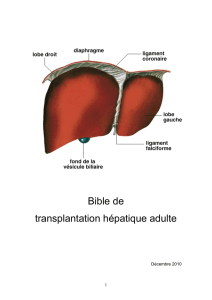
Bible d’Anesthésie en
Transplantation Hépatique Adulte
Docteur Fernande Lois
Décembre 2010

2
Evaluation pré-opératoire.
A la consultation
Les patients proposés pour le programme de transplantation hépatique adulte ( sauf
urgence) sont évalués à la consultation d’anesthésie avant d’être inscrits en liste
d’attente.
Le but de cette consultation est de :
- synthétiser le dossier du patient et le bilan complémentaire déjà réalisé afin
de mettre en évidence d’éventuels éléments manquants pouvant modifier la
prise en charge ultérieure, d’évaluer la gravité de la maladie, d’améliorer la
prise en charge et de mettre en évidence d’éventuelles contre-indications à la
transplantation
- préparer un plan d’anesthésie spécifique pour le patient
Les éléments suivants doivent se trouver dans la consultation :
- Indication de la transplantation hépatique
- Classification de Child-Pugh et / ou de MELD lors de la consultation
Classification de Child-Pugh
Ascite
absente
modérée
Importante
Albuminémie (g/l)
> 35
30-35
< 30
Encéphalopathie
absente
modérée
Sévère
Bilirubinémie (µmol/l)
< 34
34-51
> 51
Temps de Quick (%)
> 56
45-56
< 45
Points
1
2
3
Child A 5-6 points, Child B 7-9 points, Child C 10-15 points
Score de MELD
3,8 x Ln ( bilirubine mg/dl) + 11,2 X Ln (INR) + 9,6 X Ln ( créatininémie mg/dl) + 6,4 X étiologie
Etiologie : 0 si choléstatique ou alcoolique , 1 si autre étiologie

3
Sur base de la physiopathologie de l’insuffisance hépato-cellulaire , les examens
complémentaires suivants devront également se trouver dans le dossier ou avoir
été programmés :
Anomalies de l’hémostase, de la coagulation et de la fibrinolyse :
- Troubles de l’hémostase primaire :
o Thrombopénie : hypersplénisme sur H.T.P., diminution de la
production médullaire, consommation en cas de coagulation
intravasculaire
o Thrombopathie : insuffisance rénale souvent associée, rôle du
NO
- Troubles de l’hémostase secondaire :
o Diminution des facteurs de coagulation suite à la diminution de la
synthèse protéique : facteurs II, V, VII et X
o Synthèse accrue des facteurs vitamine-K dépendants,
fibrinogène et facteur VIII et sur-expression du facteur von
Willebrand suite à une dysfonction endothéliale
o Diminution de l’épuration de certains facteurs activés
- Anomalies de la fibrinolyse
o Accélération de la fibrinolyse suite à l’augmentation de
l’activateur tissulaire du plasminogène et à une diminution de
l’activité de l’inhibiteur de cet activateur
L’ensemble de ces anomalies augmentent en général le risque hémorragique mais
également celui des phénomènes thrombo-emboliques. Toute agression (
infection, …) peut entraîné un état de C.I.V.D..
Quels tests en pré-opératoire ?
Habituellement, les patients sont vus en consultation d’hémostase.
Les éléments à vérifier sont :
Numération plaquettaire
(PFA : test de fonction plaquettaire)
Temps de prothrombine
Temps de céphaline activé
Temps de thrombine
Mesure de différents facteurs : facteur V et fibrinogène
Temps de lyse des euglobulines
Produits de dégradation de la fibrine
Thromboélastogramme

4
Modifications hémodynamiques
Anomalies cardiovasculaires
Au cours de la cirrhose, on observe une vasodilatation artérielle systémique.
En effet, l’H.T.P. est associée à la libération de molécules vasodilatatrices ( NO,
prostacyclines) activant de manière chronique le système sympathique et le
système rénine-angiotensine. La vasodilatation provoque l’ouverture de shunts
artério-veineux. De plus, on observe une altération des mécanismes
régulateurs avec une diminution du baroréflexe et de la réponse aux
catécholamines.
Syndrome hyperkinétique avec une augmentation du débit cardiaque et une
baisse de la pression artérielle systémique.
Si le système rénine-angiotensine et le système sympathique sont dépassés
pour limiter la vasodilatation artérielle, on pourra observer les complications
suivantes : syndrome hépato-pulmonaire, syndrome hépato-rénal,
hypertension porto-pulmonaire.
Dysautonomie neuro-végétative
On peut observer une altération de la fonction cardiaque en cas de cirrhose
sévère prolongée ( cardiomyopathie cirrhotique), d’intoxication alcoolique ou de
choléstase majeure.
5 à 10 % des cirrhotiques présentent une coronaropathie. Sa présence est un
facteur de mauvais pronostic après transplantation.
Quels tests en pré-opératoire ?
ECG
Echographie cardiaque + recherche shunts
Cathétérisme cardiaque droit si H.T.A.P. lors de l’échographie
Bilan coronarien si anamnèse positive / douteuse et/ou facteurs de risque :
âge > 70 ans
maladie cardiaque ischémique ( sauf revascularisation récente)
décompensation cardiaque congestive
antécédents AVC ou AIT
traitement par insuline
créatinine sérique > 2.0 mg/dl

5
Fonction rénale
La cirrhose s’accompagne d’une rétention hydro-sodée importante. La
vasodilatation splanchnique en est la cause et elle est entretenue par les
mécanismes régulateurs que sont le système rénine-angiotensine et la sécrétion
d’ADH auxquelles il faut probablement ajouté des anomalies des prostaglandines et
une diminution de la production d’albumine.
ascite +/- épanchement pleural avec des répercussions ventilatoires.
anomalies hydro-électrolytiques : hyponatrémie, hypokaliémie
insuffisance rénale dont les causes peuvent être multiples ( syndrome hépato-
rénal)
Quels tests en pré-opératoire ?
Ionogramme sanguin
Calcémie
Phosphorémie
Uricémie
Urée
Créatinine
Protidémie et électrophorèse des protéines
Urines de 24 heures : ionogramme, clairance de la créatinine, protéinurie, microalbuminurie
Echographie abdominale
Modifications pulmonaires
En plus des antécédents ( tabagisme, asthme, …), 2 syndromes spécifiques peuvent
exister, ce sont :
le syndrome hépato-pulmonaire : association d’une maladie chronique du foie
avec hypertension portale , d’une hypoxémie ( effet shunt et shunts vrais) de
repos associée à une orthéodoxie avec augmentation du gradient alvéolo-
capillaire ( > 20 mmHg) en oxygène et dilatations vasculaires intra-pulmonaires.
l’hypertension porto-pulmonaire : association d’une maladie cirrhotique et
d’une hypertension artérielle pulmonaire ( PAP moyenne > 25 mmHg)
Quels tests en pré-opératoire ?
RX de thorax face et profil
Gaz du sang couché et debout ( à défaut saturométrie )
E.F.R. en fonction du contexte
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%