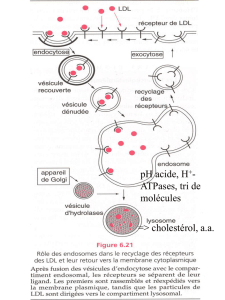
EGFR : epidermal growth factor receptor

Simonnet Jean Chateigner Aurélien
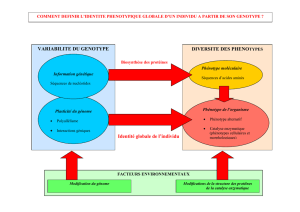
Le gain et la perte de fonctions
Voie de signalisation EGFR chez la
drosophile
EGFR : epidermal growth factor receptor
EGF est un facteur de croissance, protéine de faible poids moléculaire qui intervient dans différentes
choses : la prolifération cellulaire, la différentiation, la survie (conditions physiologiques et
physiopathologiques (cancers..))
Les facteurs de croissances sont reconnus par des récepteurs membranaires, la plus souvent
possédant une activité tyrosine kinase. Le signal de transduction résultant de l’activation de ces
récepteurs débute alors par la modification de l’activité de certaines protéines par phosphorylation.
On a alors différentes réponses cellulaire (prolifération, différentiation, croissance, survie,
angiogenèse)
Les récepteurs cellulaires peuvent être de différents types : protéine canaux, associé à un second
messager ou possédant une activité enzymatique. Ici ce sont des récepteurs à activité enzymatique
tyrosine kinase. La majorité des facteurs de croissance sont associés à des récepteurs de ce type.
Pour EGF, on trouve 4 types de récepteurs TK chez les mammifères : EGFR, ERPB2, ERPB3, ERPB4.
Drosophile
Implication chez les embryons en cours du développement : détermination rétine neurale, croissance
des disques imaginaux, spécification dans les veines des ailes. Chez certains mutants de drosophiles
Récepteur (EGF-R)
Signal (EGF)
Fixation du
signal sur son
récepteur
Cascade de transduction
Enzymes
Protéine du cytosquelette
Régulation de gènes
Cibles :
Réponses :
Métabolisme
Modulation de
l’expression génique
Modification de la forme
et de la mobilité cellulaire

Simonnet Jean Chateigner Aurélien
(soit au niveau des récepteurs, ou au niveau de la voie de signalisation) on peut avoir un dérèglement
cellulaire (prolifération).
Chez les drosophiles, il n’y a qu’un seul récepteur EGF-R, constitué d’une seule chaine d’acides
aminés. C’est une glycoprotéine transmembranaire, composée de 3 domaines transmembranaires :
un domaine externe de reconnaissance du ligand, un domaine intracellulaire qui a une activité TK
(tyrosine kinase). Pour que l’activité enzymatique soit révélée, la dimérisation du récepteur est
nécessaire.
On va déterminer la position des différents acteurs protéiques au sein de la voie de transduction,
avec le mutant EGFR au niveau de la voie de transduction.
Dimérisation
TK révèle une
phosphorylation
dans les substrats
Transduction cellulaire
Impact sur activité génique
protéique
EGF
EGFR
Transduction
Cellules sécrétrices
TK
TK
TK

Simonnet Jean Chateigner Aurélien
Analyse des phénotypes des veines des ailes
Les différents mutants
Le mutant EGFR
Le mutant de phénotype sauvage a un EGFR fonctionnel, et dont l’expression est normale. Au
contraire, l’allèle EGFR-gof (gain of fonction) a une RasTK dont la partie intracellulaire est modifiée,
elle exprime une activité quasiment constitutive, plus forte que l’activité liée au phénotype sauvage.
L’allèle EGFR-lof (lost of fonction) diffère quant à elle de gof, son activité est moins forte que celle
liée au phénotype sauvage.
La protéine Ras
On n’observe qu’un mutant : Rashypo//TM3. L’allèle Ras est hypomorphe. TM3 code pour un gène
balanceur.
La protéine Rold
1 mutant Rlhypo//Rlhypo (homozygote), il a une activité plus réduite que la protéine sauvage.
On va repositionner Ras, Rold et EGFR dans la transduction cellulaire. Lorsque les mutations
surviennent dans la structure dans GF, on obtient des R-GF ou des acteurs de la transduction
cellulaire, un dérèglement de la prolifération peut être observé.
L1
L2
L3
L4
L5
ACV
PCV

Simonnet Jean Chateigner Aurélien
Première partie (TP3)
Ce TP sera effectué en plusieurs phases :
- Analyse de EGFR-gof//EGFR-Gof
- Analyse du croisement EGFR-gof//EGFR-Gof x [+]
- Analyse de Rashypo//TM3
- Analyse du croisement Rashypo//TM3 x [+]
- Analyse du croisement Rashypo//TM3 x EGFRgof// EGFRgof
Nos buts au cours de ce rapport seront :
- De schématiser le ou les génotypes obtenus
- D’étudier la répartition dans chaque souche ou descendance
- De démontrer l’utilité du croisement avec le sauvage
- De faire une première conclusion sur l’organisation de la transduction
Analyse de EGFR-gof//EGFR-Gof
Voici ce que l’on obtient : des mouches avec des ailes comprenant des veines ectopiques. Voivi un
schéma du phénotype des ailes obtenu :
Analyse du croisement EGFR-gof//EGFR-Gof x [+]
On retrouve le même phénotype qu’à l’état homozygote : on montre que le gène s’exprime de la
même façon à l’état hétérozygote. On peut donc s’en servir pour un croisement où il s’exprimerai à
l’état état hétérozygote.
L1
L2
L3
L4
L5
ACV
PCV
Veine ectopique

Simonnet Jean Chateigner Aurélien
Analyse de Rashypo//TM3
On n’observe aucun phénotype visible.
Analyse du croisement Rashypo//TM3 x [+]
On observe deux phénotypes différents en F1 : la moitié des mouches présentent sur l’aile, la veine
L2 tronquée ; l’autre moitié présente des soies courtes, dues au balanceur TM3. On montre que
Rashypo s’exprime à l’état hétérozygote, mais pas en présence de TM3 : On met ici en évidence des
problèmes de pénétrance dus à des interactions entre TM3 et Rashypo.
L1
L2
L3
L4
L5
ACV
PCV
L1
L2
L3
L4
L5
ACV
PCV
 6
6
1
/
6
100%