Premières S – St Thomas d`Aquin Mornant

Premières S – St Thomas d’Aquin Oullins - Physique/Chimie – DS du 20/11/10
Page 1 sur 2
PHYSIQUE/CHIMIE
DS N°2
Durée : 2,5 heures
ATTENTION A LA REDACTION !
Calculatrice autorisée.
Tout résultat donné sans unité sera compté faux
PARTIE PHYSIQUE 12 points
► Exercice 1 : La discothèque d’Hilaire 2,5 points
Un brin nostalgique, Hilaire contemple sa discothèque remplie de disques 33 tours en vinyle, de 30,0
cm de diamètre, qu’il écoutait sur son tourne-disque avant l’invention des disques compacts.
Questions :
1°/ Le terme « 33 tours » correspond au nombre de tours par minute. Déterminer la vitesse angulaire
en radian par seconde d’un « 33 tours ». (1 pt)
2°/ En déduire la vitesse d’un point de la circonférence. (0,5 pt)
3°/ Comparer cette vitesse avec celle d’un point de la circonférence d’un « 45 tours » de 17,4 cm de
diamètre. (1 pt)
► Exercice 2 : Vecteur vitesse d’un projectile 5 points
Les positions successives du centre d’inertie G d’un projectile sont repérées à intervalle de temps régulier
dans un repère (O ;
i
,
j
)associé au référentiel terrestre. L’axe (O,
i
) est horizontal orienté vers la droite et
l’axe (O,
j
) est vertical ascendant. Les coordonnées de G au cours du mouvement sont :
t(s)
0
0,20
0,40
0,60
0,80
1,0
1,2
1,4
1,6
x(m)
0
0,79
1,57
2,36
3,14
3,93
4,72
5,50
6,29
y(m)
0
1,96
3,52
4,68
5,44
5,80
5,76
5,32
4,48
Questions :
1°/ Tracer la trajectoire de G à l’échelle 1 cm pour 1m. Quel est le type de la trajectoire. (2 pts)
2°/ Déterminer la valeur de la vitesse aux dates t = 0,20 s ; 1,0 s et 1,4 s. (1,5 pts)
3°/ Tracer le vecteur vitesse de G aux dates t = 0,20 s ; 1,0 s et 1,4 s à l’échelle 1 cm pour 4 m.s-1.
(1,5 pts)
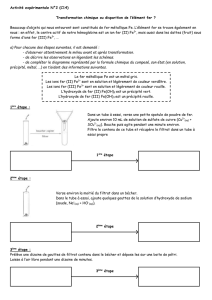
► Exercice 3 : Mouvement d’un point d’un mobile autoporteur 4,5 points
Le schéma ci-dessous présente une réduction de l’enregistrement des positions d’un point d’un
mobile autoporteur. Ces positions sont relevées à intervalles de temps consécutifs égaux à 20 ms. La flèche
indique le sens du mouvement. La distance réelle entre les deux premiers points est de 4,0 cm.
Questions :
1°/ Sur le schéma précédent représenter la trajectoire et numéroter les points de A1 à A6.
La caractériser brièvement. (0,5 pt)
2°/ Déterminer l’échelle de reproduction de cet enregistrement. (1 pt)
3°/ Calculer les valeurs de vitesses en A2 et A5. (2 pts)
4°/ Représenter les vecteurs vitesses en ces deux positions à l’échelle 1 cm pour 1 m.s-1. (1 pt)

Premières S – St Thomas d’Aquin Oullins - Physique/Chimie – DS du 20/11/10
Page 2 sur 2
PARTIE CHIMIE 13 points
► Exercice 4 : Composés ioniques et solutions ioniques 2 points
1°/ Donner la formule statistique et le nom du solide ionique dissous pour obtenir les solutions
ioniques suivantes : Cr = chrome
a/ Cr3+(aq) + 3Cl-(aq) b/ 2Na+(aq) + SO42-(aq)
2°/ Ecrire les équations chimiques de dissolution des solides ioniques suivants et nommer la solution
obtenue :
a/ Cu(OH)2(s) b/ Al2(SO4)3(s)
► Exercice 5 : Dissolution et précipitation 5 points
On verse quelques gouttes de solution d’hydroxyde de sodium (soude) dans une solution de sulfate
de fer II. On observe alors la formation d’un précipité vert kaki.
1/ ANALYSE QUALITATIVE
a/ Les deux solutions ci-dessus ont été préparées à partir de pastilles d’hydroxyde de sodium
et de la poudre de fer II FeSO4(s). Ecrire les équations de dissolution dans l’eau de ces deux
solides ioniques. (0,5 pt)
b/ Sachant que le sulfate de sodium est un solide ionique n’existant pas en solution, donner la
formule du précipité d’hydroxyde de fer II observé. Ecrire alors l’équation chimique traduisant
cette formation de précipité. (0,25 pt)
c/ De nombreux ions métalliques peuvent être caractérisés suite à l’addition d’une solution
d’hydroxyde de sodium. Quel ion a été caractérisé ici ? (0,25 pt)
d/ Citer deux autres ions métalliques caractérisés par un test similaire et préciser pour chacun
ce que l’on observe lors de la réalisation du test. (0,5 pt)
2/ ANALYSE QUANTITATIVE
Dans V1 = 100,0 mL d’une solution de sulfate de fer II de concentration c1 = 2,0.10-3 mol.L-1 en soluté
FeSO4 apporté, on verse V2 = 2,0 mL d’une solution d’hydroxyde de sodium de concentration
c2 = 2,0.10-2 mol.L-1 en soluté (NaOH) apporté.
a/ A partir des équations traduisant la préparation des solutions ci-dessus et à partir des
solides ioniques correspondants, déterminer les quantités de matières d’ions Fe2+(aq)et
HO-(aq) impliquées dans la réaction de précipitation. (1 pt)
b/ Dresser alors le tableau d’avancement de la réaction de précipitation. (2 pts)
c/ Déterminer la masse de précipité à l’état final. (0,5 pt)
Données :
M(Fe) = 55,8 g.mol-1 M(O) = 16,0 g.mol-1 M(H) = 1,0 g.mol-1
► Exercice 6 : Synthèse du sulfure d’Aluminium 6 points
Sur une brique, on place un mélange de 5,4g de poudre d’aluminium Al et de 12,2g de poudre de soufre S. On
chauffe fortement ce mélange à l’aide d’un bec bunsen et on observe une vive incandescence qui se propage
à tout le mélange. Après refroidissement, on constate qu’il s’est formé du sulfure d’aluminium (solide de
formule Al2S3)
Questions :
1°/ Déterminer les quantités de matière à l’état initial. (0,5 pt)
2°/ Dresser le tableau descriptif de l’évolution du système. (1 pt)
3°/ Déterminer le réactif limitant et la valeur de l’avancement final. (1 pt)
4°/ Déterminer les quantités de matière des espèces constituant le système chimique final. (1 pt)
5°/ Sur un unique graphique, tracer les courbes représentant l’évolution des quantités de matière
n(Al), n(S) et n(Al2S3) en fonction de x au cours de la transformation. (1,5 pt)
6°/ Déterminer la masse de sulfure d’aluminium formée et la masse du réactif restant en excès. (1 pt)
Données : M(Al) = 27,0 g.mol-1 M(S) = 32,1 g.mol-1
____________________________
1
/
2
100%