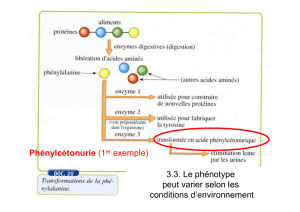
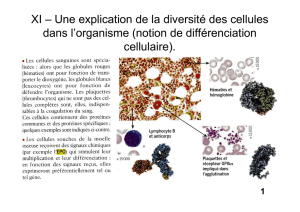
C. Mort des Globules Rouges : Hémolyse physiologique

1/10
Gérard Charlotte
Pouëdras Marie
Hémato 15/04/11
Dr GUILLET Benoît
Physiologie du globule rouge
I. L'Hémoglobine
A. Introduction
Molécule essentielle pour la fonction du GR
Transport dans le GR permet :
protection contre l'oxydation
distribution efficace d' O2 aux tissus
Principale fonction : transport d'O2
capté au niveau des échanges alvéolo-capillaires
libéré aux tissus
Structure de l’Hb :
protéine polymérique de 64 kDa
composée de 4 molécules de globine, 4 molécules d’hème, 4 atomes de Fe 2+ (ferreux) + 4 O2 au
maximum (saturation maximale)
B. La synthèse
Structure protéique = globine, et héminique =hème
Synthèse de la globine :
Synthèse classique qu’une protéine : ADN => ARN=>protéine
Synchronisation des synthèses de l’hème et de la globuline : l'hème synthétisée stimule la synthèse des
chaînes de globine. Et vice versa, la synthèse de la globine entraîne une dépendance de la synthèse
d’hème.
Si défaut de synthèse de la globine => défaut de la synthèse de l’hème.
Association des molécules d'hème et de globuline
o une chaîne alpha s’associe à une chaîne non alpha =>dimère (par exemple l'HbA : αβ)
o association de deux dimères : α2β2
o association de ces 2 dimères avec 4 molécules d'hèmes =>1 molécule d'Hb (HbA)
C. La molécule d'hème
Porphyrine contenant :
4 noyaux pyrrols à sommets azotés se faisant face
8 chaînes latérales : 2 propioniques (P ), 2 vinyl (V) et 4 méthyl (M). Les 2 chaînes propioniques
sont les plus importantes, elles permettent la liaison à la globine.
1 atome de fer ferreux Fe 2+ central, fixé à 4 atomes d'azote.
Le fer est au milieu de la molécule d'hème et il est lié :
- de façon directe à la globine au niveau du noyau imidazolique de l'histidine proximale
- de façon indirecte sur le N imidazolique de l'histidine distale de la globine, par l'intermédiaire de
l'O2.

2/10
Si mutation histidine, alors pas de liaison avec le fer et défaut de liaison globine-hème.
=> anémie héréditaire (défaut d’Hb)
Si absence de fer => anémie par carence martiale.
D. La globine
1. Structure
Ensemble de 4 chaînes polypeptidiques:
Structure primaire:
- 4 types principaux : α (alpha), β (béta), γ (gamma), δ (delta)
- 2 types accessoires : ε (epsilon), ζ (zéta )
- chaîne alpha : 141 AA
- chaînes non alpha : 146 AA.
Structure secondaire :
8 segments hélicoïdaux nommés A à H
Structure tertiaire
-liaisons intra-chaînes permet une stabilité => structure globulaire (liaisons faibles)
-création d'une poche hydrophobe: liaison à l'hème.
Une anomalie de structure entraîne une hémoglobinopathie (comme c'est le cas dans la thalassémie)
Structure quaternaire: Molécule associant les deux dimères
- La chaîne α (alpha) et la chaîne non α (non alpha) sont liées par des liaisons fortes
- Les dimères sont liés par des liaisons faibles,
- Sur chaque globine, il y a une poche hydrophobe où se fixe l'hème. Au centre, se fixe la molécule de 2,3
DPG
-4 molécules de globine liées entre elles: pour HbA
Liaison forte entre α1β1 et α2β2 (peu de plasticité)
Liaison faible entre α1β2 et α2β1 ce qui permet contraction et relaxation des molécules d'où la
viscosité.

3/10
2. Gènes de la globine
-gène α : 2 gènes identiques à proximité sur le chr 16
-gène γ, δ, β : sur le chr 11, ils se font suite et s'expriment successivement au cours du développement : si
diminution de l'activité de l'un, augmentation de l'activité des autres.
Entre γ1 et γ2: différence d'un acide aminé Ala 136 ou Gly 136
3. Évolution de la synthèse des chaînes de la globine en fonction de
l'âge
Donc:
- chaîne ε (epsilon) apparaît très tôt, puis disparaît avant la naissance. Caractérise l'hémoglobine
embryonnaire.
- chaîne γ (gamma) : apparition très importante au tout début de la vie fœtale puis disparaît pour
être presque inexistante à l'age adulte.
- chaîne α (alpha) : apparition très peu de temps après celle de gamma puis persiste de manière
importante.
- chaîne β (bêta): sur le Chr 11 apparaît donc en dernier : apparition au stade fœtal ou en période
néonatale, puis augmentation progressive.
- chaîne δ (delta): apparition presque en même temps que bêta mais n'augmente pas beaucoup chez
l'adulte.
=> Adulte : αβ (+++) et δ

4/10
On voit que l'hémoglobine change selon l'âge.
- Au stade embryonnaire, on a l'hémoglobine Gowers avec les chaînes zêta et epsilon.
- Au stade fœtal, on a l'hémoglobine F avec des chaînes alpha 2 et gamma 2. HbF a une affinité
pour l'O2 plus forte que HbA (pas toujours un avantage car délivre moins facilement l’oxygène).
En fin de gestation, on a une diminution de HbF (α2γ2) et apparition d'HbA (α2β2). Apparition
également des premières traces de HbA2 (α2δ2)
- A 6 mois, formule voisine de celle de l'adulte.
HbA : 97-99%; HbA2 : 1-3,5% et traces d'HbF
Présence également des produits de dégradation de l'Hb normale: HbA1c ( hémoglobine glyquée).
Identification des variétés d'hémoglobines normales
- par électrophorèse de l'hémoglobine. Cette technique permet de séparer facilement l'HbA de
l'HbA2 de l'HbF car ces molécules ont un Pi différent et donc une migration différente.
L'électrophorèse nous permet d'obtenir les profils des fœtus, nouveaux nés et adultes. Le fœtus a
beaucoup d'HbF, peu d'HbA et pas d'HbA2. Les nouveau-nés ont un peu des trois. Les adultes ont
beaucoup d'HbA, peu d'HbA2 et pas d'HbF.
fœtus nv-né adulte
- étude de la résistance à la dénaturation alcaline. Cette technique permet de doser l'HbF qui est très
résistante aux pH alcalins
- Test de Kleihauer (biochimique ou immunochimique) consiste en une recherche des Globules
Rouges fœtaux dans le sang maternel. Sert donc à la recherche des incompatibilités foeto
maternelles érythrocytaires
E. Molécule complète d'Hb
4 chaînes de globine (dont 2 alpha et 2 bêta en ce qui concerne l'Hémoglobine A) dont chacune comprend
une molécule d'hème dont chacune comprend un atome de fer.
Liaison hème-globine: - entre chaines latérales d'acide propionique de l'hème et globine
- entre fer de l'hème et globine (liaison directe et indirecte)
HbA
HbF
HbA2

5/10
F. Fonctions de l'Hb
1. fonction principale : transport d’O2
Au maximum 4 O2 par molécule d'hémoglobine, on parle alors d'oxyhémoglobine.
Courbe de saturation de l'hémoglobine en O2 en fonction de la PaO2 : allure sigmoïde.
La PaO2 reflète la concentration en O2 des tissus où passe le globule rouge. Cette pression est plus
importante au niveau des poumons (où l'hémoglobine va capter l'O2) qu'au niveau des tissus (où
l'hémoglobine va relâcher l'O2).
La myoglobine se sature très vite en O2 (pour des Pressions en O2 faibles) donc hyperaffinité. Elle
relargue donc peu l'O2 aux tissus.
Suite à certaines mutations, on peut avoir:
Hb à affinité accrue, ne libère pas l’O2 (même problème qu'avec la myoglobine : hypoxie tissulaire)
Hb à affinité diminuée : difficultés à capter l'O2 au niveau pulmonaire et anémie (distribue peu d’O2)
(c'est le cas dans les carences en Fer : mauvaise fixation O2)
- L'affinité dépend énormément de la capacité des dimères alpha-bêta à s'étirer ou se contracter. On parle
de « respiration de l'hémoglobine » :
L’Hémoglobine désoxygénée => dilatation. Du 2,3 DPG vient se fixer dans la poche hydrophobe ce qui
empêche la liaison avec l'O2 lors de faibles PaO2 (c'est ce qui se passe au niveau des tissus, une fois
l'oxygène délivré, le 2,3 DPG va remplir la poche)
Hb oxygénée =>contraction car la PaO2 augmente (au niveau pulmonaire) donc chasse du 2,3 DPG ce qui
permet aux hèmes de fixer l'oxygène.
-La capacité de l'hémoglobine à se contracter est due aux liaisons faibles entre les 2 dimères qui
permettent le glissement des chaines β1 sur α2 et β2 sur α1
2. Autres fonctions de l'Hb:
- transport de CO2,: environ 10% du CO2 d'origine pulmonaire
les 90% restant, sont sous forme de CO3H- plasmatique
- transport du NO
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%