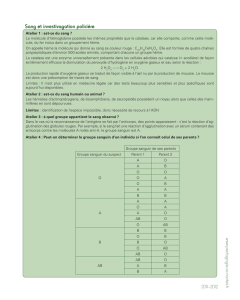
Hémoglobine :

Hémoglobine :
L’hémoglobine est le pigment responsable de la coloration des GR, constitué d’hème et de
globine.
Elle est chargée du transport d’oxygène et du C02 et des échanges gazeux au niveau des tissus
et des poumons
I- Aspects biochimiques
A- Structure:
L’hémoglobine (Hb) est un hétéro tétramère formé de 4 chaînes de globines et de 4 molécules
d’hème
C’est un hétéro tétramère de globine, les molécules d’hème sont dans la poche de globines
L’hème est une protoporphyrine α qui comporte un atome de fer ferreux Fe++ présentant 6
liaisons de coordinance dont :
o 4 s’établissent avec les azotes des noyaux pyrroles de l’hème.
o le 5ème forme une liaison stable avec l’histidine proximale.
o la 6ème se fixe sur l’histidine distale par l’intermédiaire d’une molécule d’O2 dans
l’oxyhémoglobine (dans la structure désoxygénée, cette 6ème liaison disparaît et le Fe reste sous
sa forme réduite mais n’échange plus que 5 liaisons de coordinance)
La globine est la partie protéique de l’Hb, chaque molécule d’Hb est formée de 4 chaînes de
globine : 2 chaînes α et 2 chaînes de type non α, leur structure est très proche (différence de
quelque acide aminé) l’hémoglobine adulte ou A est formée de 2 α et 2 β
o La structure primaire : correspond à une chaîne polypeptidique.
o La structure secondaire : résulte de l’enroulement hélicoïdal des chaînes polypeptidiques.
o La structure tertiaire : correspond à une structure globulaire, compacte, ménageant en son
centre la poche de l’hème
La structure quaternaire : résulte de l’assemblage des chaînes α et β entre elles pour former le
tétramère de globine. Au centre de l’Hb oxygénée on trouve le 2-3 diphosphoglycérate (2-3 DPG)
qui assure le passage de la forme oxygénée à la forme désoxygénée (=libération de l’oxygène)
B- Biosynthèse
La biosynthèse de l’Hb commence au stade du proérythroblaste et s’achève à celui du
réticulocyte.
La synthèse des chaînes de la globine :
o Elle s’effectue selon le mécanisme général de la synthèse protéique (transcription de l'ARN puis
traduction)
o Elle est induite par l’hème ; et donc le déficit en Fe (donc en hème) entraîne l’arrêt de sa
biosynthèse.
La synthèse de l’hème :
o Elle s’effectue indépendamment de celle de la globine. L’hème ne vient que secondairement
s’accrocher aux chaînes néo-synthétisées pour réaliser la sous unité d’Hb.
o Certaines étapes de la synthèse sont localisées dans les mitochondries, d’autres dans le
cytosol.
La régulation de la synthèse est assurée par le produit final: l’hème libre exerce une rétro
inhibition de sa synthèse lorsqu’il se trouve en excès par rapport aux chaînes de globine.

• les érythroblastes synthétisent un noyau porphyrinique tétrapyrrolique appelé
protoporphyrine, avant d’y insérer le fer
• la synthèse de l’héme est mitochondriale (au début, et à la fin) et cytoplasmique
• les précurseurs sont la glycine et le succinyl-CoA
• la régulation principale se situe sur l’ ALA synthétase
• le fer est incorporé à la dernière étape par l’hème synthétase
II.Différentes types d’hémoglobine :
• Chez l’homme, plusieurs hémoglobines se succèdent au cours de la vie et, à tout
moment. Ces hémoglobines se distinguent par la nature des sous-unités qui les
constituent.
Ces modifications s’effectuent parallèlement au changement du lieu d’érythropoïèse (sac vitellin
chez l’embryon, foie, rate et moelle osseuse chez le fœtus, moelle osseuse chez l’adulte normal
1.Hémoglobines normales embryonnaires : deux chaînes de la famille α coexistent : ζ, qui
apparaît la première, puis α. De même, il existe deux chaînes de type β : ε et γ.
• Ces diverses sous-
unités permettent de réaliser les trois hémoglobines de l’embryon,
- Hb Gower 1 (ζ2,ε2)
- Hb Gower 2 (α2- ε2)
- Hb Portland (ζ2, γ2)
- Hb fœtale (Hb F) (α2γ2). À partir du 37ème jour
2.Hémoglobines normales fœtales :
• L’Hb F (α2γ2) (90 %) est le constituant hémoglobinique principal de la vie fœtale.
3.Hémoglobines normales adultes :
• L’Hb A (α2β2) : 95 %.
• l’Hb A2 (α2δ2): 2,5 %.
• L’Hb F: inférieure à 1 %.
III- Aspects génétique :
Les gènes de l’hémoglobine sont répartis en deux groupes :
o les gènes de type α sur le chromosome 16,
o les gènes non−α sur le chromosome 11.
Il existe au niveau du chromosome 16 deux gènes α1 et α2 proches l’un de l’autre donc la
biosynthèse de la chaîne α est sous le contrôle de 4 gènes α par génome diploïde.

Pour les gènes du complexe β (ε,γ,δ,β) :
o il existe un gène de structure par génome haploïde pour les chaînes ε, δ et β.
o pour les chaînes γ, qui diffèrent au niveau de l’aminoacide 136 (Alanine ou glycocolle), il y a 2
gènes de structure par chromosome, Aγ et Gγ.
VI. Etude de l’hémoglobine :
Electrophorèse de l’hémoglobine :
III- Conclusion :
.
La synthèse de l'hémoglobine peut faire l'objet de plusieurs pathologies qui peuvent avoir un
pronostic vital
1
/
3
100%