B) Voie IV

1
Les traitements anticancéreux : aspects pratiques
Dr Danielle Prébay
(
Ce cours est plus une vision pratique de ce qui se fait dans les hôpitaux.
Ndlr : CT = ChimioThérapie
Historique : première moitié du 20ème siècle : deux armes : chirurgie et radiothérapie (comme
accélérateurs, bombes à cobalt)
La chimiothérapie (CT) anticancéreuse apparaît plus tardivement : 1942 : Goodman : effet
leucopéniant des gaz de combat : moutardes à l’azote. Ces produits sont encore utilisés.
1ère CT de la leucémie publiée en 1948 : Méthotrexate (MTX) qui est un antimétabolite.
La Ct a une action ubiquitaire sur l’organisme par rapport à radiothérapie ou chirurgie qui n’avaient
pas d’effets sur les métastases disséminées dans l’organisme.
Différents types de traitement :
Chirurgie : dans les tumeurs solides
CT = traitement cytotoxique. Ne plus dire cytostatique ou antimitotique (les vrais
antimitotiques sont les poisons du fuseau)
Thérapies ciblées : par Ac monoclonaux ou par inhibiteurs de tyrosine kinase comme le
Glivec. Ces thérapies sont propres à des tumeurs qui surexpriment certains récepteurs.
Antiangiogéniques
Inhibiteurs de protéasomes
Immunothérapie : interférons, interleukines
Hormonothérapie : pour les deux cancers hormonodépendants : prostate et sein (et oui, un
homme peut avoir le cancer du sein !)
A) Principes de la CT
Objectif : éliminer les cellules cancéreuses en préservant les saines. Mais c’est impossible : on n’a
aucun critère pour les différentier. D’où une toxicité élevée pour les cellules saines : l’index
thérapeutique (= balance efficacité/toxicité) est nul. Donc quand on est efficace on est toxique.
Aucun cytotoxique n’est spécifique des seules cellules cancéreuses.
L’activité d’un cytotoxique peut être la conséquence d’une interaction directe ou indirecte avec
l’ADN cellulaire de la cellule tumorale.
Classification : en fonction du mécanisme d’action et non leur formule chimique. 4 familles :
- Alkylants : forment un pont entre les doubles hélices d’ADN
- Inhibiteurs de topoisomérases + intercalants : bloquent la ressoudure de l’ADN
- Antimétabolites : interfèrent dans la constitution de l’ADN
- Antimitotiques
Les cellules malignes ne sont pas toutes au même stade de reproduction : donc on associe plusieurs
cytotoxiques. La polychimiothérapie permet d’améliorer l’index thérapeutique. On recherche un
gain d’efficacité sans augmenter les effets toxiques.
L’association ou combinaison vise à obtenir un effet au moins additif = addition des effets de
chaque substance individuellement, ou synergique = activité supérieure à la somme des activités
individuelles.

2
Pour étudier les combinaisons on réalise à l’échelle mondiale des études randomisées
comparatives : nouveaux produits, nouvelles associations, nouvelles posologies, nouveaux modes
d’administration. On compare avec la référence du moment.
Cette association doit comprendre :
- des cytotoxiques actifs individuellement sur la tumeur concernée
- des cytotoxiques à mécanisme d’action différents pour une additivité des effets
- une absence de compétition métabolique
- une absence de mécanisme de résistance croisée connue
- une additivité des effets sur le cycle cellulaire
- une non-additivité des effets indésirables
On associe pas plusieurs antimitotiques par exemple.
Les produits sont administrés sous forme de protocole : ces protocoles( combinaison de
cytotoxiques) ont des noms (souvent initiales des produits) et sont renouvelés à intervalles variables
(souvent 3 semaines, mais c’est selon l’intervalle de renouvellement des cellules) : c’est une série de
cures.
On associe des CT et si besoin (ou possible) une thérapie ciblée.
Exemple : FEC 100 (protocole de base pour le cancer de sein)
Protocole d’une demijournée. J1 = J22. On renouvelle 6 fois.
5 Fluoro uracile
antimétabolite
500mg/m2
(posologies exprimées en m2 de
surface corporelle)
solution dans Na 0,9%
seringue ou flacon ou poche
PVC
perfusion 1h
A (ordre d’administration)
E-DOX
Epirubicine
Farmorubicine ®
Intercalant
100 mg/m2
solution dans Na 0,9%
IVD (Intra veineuse directe) ou
perfusion 10 minutes
B
CPM
Cyclophosphamide
Endoxan®
Alkylant
500 mg/m2
solution dans Na 0,9%
perfusion 10 minutes
C
La surface corporelle est fonction du poids ou de la taille. Si surpoids on ne va pas au-delà de 2 m2 :
on ne prend pas en compte le poids réel car il y a de la masse graisseuse, et les produits
s’accumulent dans ces graisses.
On ne mélange surtout pas les produits du protocole les uns après les autres. L’ordre est défini par
le protocole.
Toutes les anthracyclines sont rouges. La novantrone est bleu marine.
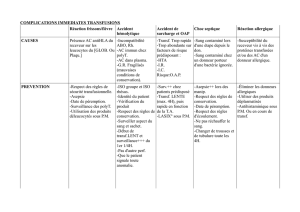
B) Voie IV
Perfusion continue avec bolus possible.
Exemple : FOL-FOX 4 : protocole classique dans le cancer du colon
J1 :
oxiplatine (alkylant) 85 mg/m2 perf 2h glucose 5%
+ acide folinique (potentialise le 5-FU) 200 mg/m2 perf 2h NaCl 0,9%
+ 5FU (antimétabolite) 400 mg/m2 intra tubulaire (IT : dans la tubulure de perfusion) pur en
seringue.

3
Bolus : 5FU : 2400 mg/m2 perf continue sur 46h. Le patient a une cassette avec pompe portable qu’il
emmène chez lui. Il dort avec, et c’est l’infirmière qui la débranche.
J1=J15 (très lourd)
On peut aussi ajouter du bevacizumab → thérapie ciblée
Conclusion : on peut mélanger les produits, les modes d’administration, les délais.
Exemple 2 : protocole trastuzumab-paclitaxel
(trastuzumab= Herceptine® = Ac monoclonal utilisé pour le cancer du sein : Ac des récepteurs
HER+++ = Erb B2; paclitaxel = poison du fuseau)
IV : cytotoxique +Ac monoclonal
J1 : trastuzumab 2 mg/kg perf 30 minutes (dose de charge 4 mg/kg)
Paclitaxel : 175 mg/m2 perf 3h
J8 : trastuzumab 2 mg/kg perf 30 minutes
J15 : trastuzumab 2 mg/kg perf 30 minutes
J1=J22
Le choix de l’Herceptine se fait après examen IHC = examen histologique de la tumeur. L’herceptine
est donc ici un adjuvant pouvant être donné toutes les 3 semaines pendant un an.
Question qui tombe souvent : quelle est la différence entre un cytotoxique et une thérapie ciblée ?
Un cytotoxique ne fait pas la différence entre cellules cancéreuses et cellules saines, et la thérapie
ciblée cible mais seulement certaines protéines et donc est utilisée que pour certains cancers.
1. Système d’administration IV :
cathéter court (abord veineux périphérique) : exceptionnel : à remplacer par de
l’intratubulaire.
Abord veineux central : dispositif IV de longue durée (DIVLD) : directement dans une veine
ou une artère de gros calibre. Ces dispositifs permettent de conserver le capital veineux,
c’est plus confortable mais risques infectieux, thromboemboliques et/ou hémorragiques.
Un cathéter veineux central classique est en silicone ou en polyuréthane tunnelisé.
Catheter multilumière : permet de ne pas mélanger les produits
Ce qui se fait le plus maintenant : la CIP = chambre implantable pour perfusion : c’est un
boîtier de petit volume en titane ou résine avec une membrane (septum) en silicone auto
occlusive (quelques mm), avec au bout un cathéter relié à la veine sous-clavière ou plus
rarement jugulaire. Cathéter de Groshong au bout (valve anti-reflux)
Le tout est implanté sous la peau (peut rester 3-4 ans).
On injecte à travers la membrane grâce à une aiguille de Huber (extrémité recourbée et très
biseautée) qui est maintenue dans le septum et à la surface de la peau avec de l’adhésif le
temps de la perfusion. (jusqu’à 5 jours). On pose la chambre quand on sait qu’il va y avoir 5-
6 cures.

4
Si ça s’infecte c’est la catastrophe. Là encore les administrations se font les unes après les autres.
On peut rencontrer des problèmes de cristallisation dans la chambre notamment entre les
antiémétisants et les cytotoxiques qui ont des pH très différents.
Le cathéter Hickmann est utilisée pour des gros volumes de perfusion (y compris pour la nutrition
du patient). Il y a une valve anti retour au bout du cathéter.
Les problèmes rencontrés sont un défaut de cicatrisation après l’implantation, une gène de la
radiothérapie (on l’implante alors du côté inverse au côté soumis à la radiothérapie, hors du
champ), une ulcération cutanée, une rotation du boîtier, une coudure du cathéter, une thrombose
(4 à 42% des cas), une nécrose cutanée (injection extravasculaire), une infection, une embolie
gazeuse (rare).
La nécrose se produit en cas d’extravasation : le produit coule à côté entre la chambre et la peau, en
dehors de l’espace vasculaire. (Paragraphe à lire sur la feuille du Dr Prébay sur UNIV-R)
Produits les plus corrosifs : anthracyclines, et pas d’antidote. On aura recours à la chirurgie.
Mesure préventive : CARDIOXANE
2. Voie intrapéritonéale
Pour les cancers de l’ovaire, du péritoine, sarcome abdomino-pelvien, métastases d’un cancer
colorectal, gastrique ou pancréatique, en palliatif des ascites.
Produits : 5FU, cisplatine, carboplatine, mitoxantrone, paclitaxel, mitomycine C, doxorubicine
-CHIPP Chimiothérapie hyperthermique: on expose le péritoine à une température de 42-43°c
pendant la durée de la perf de CT (élimination des métastases) au moment de la chirurgie
3. Voie intrapleurale
Technique associant une aspiration pleurale à une instillation d’un agent sclérosant.
Indications : traitement des épanchements pleuraux d’origine cancéreuse.
Cytotoxiques : bléomycine, cisplatine, Il-2, interféron, cytarabine, mitoxantrone.
Technique rare
4. Voie intrarachidienne
Principe : injection au-delà de la dure-mère, dans l’espace sous-arachnoïdien contenant le LCR. Pour
les médicaments qui ne passent pas la barrière hémato encéphalique.
Ex : MTX, cytarabine, thiothépa
Administration par ponction lombaire ou par voie intraventriculaire directe ou voie intrarachidienne
(reservoir d’Ommaya)
5. Implant cérébral
En cas de tumeur cérébrale
Que en complément de la chirurgie des glioblastomes (sorte de tumeur cérébrale) en rechute :
carmustine ( Gliadel®) dans la cavité laissée par l’exérèse.
6. Voie intravésicale
Pour les cancers de la vessie récidivants. Instillation d’un cytotoxique par une sonde urétrale.
Cytotoxiques : mitomycine C, thiotépa
Effets indésirables (rares): irritation locale, troubles de miction, réaction cutanée.

5
7. Voie orale
Avantages :
traitement à domicile
moins de contraintes et de risques que l’IV
meilleure qualité de vie et satisfaction du patient
mais toxicité toujours aussi importante mais différente
Inconvénients :
- biodisponiblité très variable
- tolérance variable selon l’absorption
- toxicité digestive
- observance du traitement ? (banalisation de la maladie)
Pas de schéma thérapeutique, ou pas le même qu’en IV. Quelle chronologie ? Cycles de prises ?
Si oubli : tant pis ! Pas de double dose pour compenser !
Cytotoxiques disponibles en iv :
- Alkylants : cyclophosphamide, melphalan, estramustine, lomustine, altrétamine, busulfan,
procarbazine, témozolomide
- Intercalants : idarubicine, étoposide
- Antimétabolites : MTX, fludarabine, capécitabine, tégafur-uracile, hydroxycarbamide
- Poisons du fuseau : vinorelbine NAVELBINE
Thérapies ciblées par voie orale :
inhibiteurs de tyrosine kinase : imatinib (GLIVEC®), erlonitib (TARCEVA®), et en ATU : géfitinib
(IRESSA®), sunitinib (SUTENT®)(cancer du sein), sorafenib (NEXAVAR®)
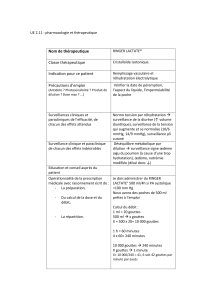
Exemple de protocole NAVELBINE
→ 1 cp / semaine
Exemple de protocole : OXA 130-EDOX50-CAP
IV : J1 A=oxaliplatine 130 mg/m2 perf 2h gucose 5% 500mL
B= épirubicine 50 mg/m2 perf 20 minutes glucose 5% 250mL
J1=J22
+cytotoxique par voie orale = capécitabine 800 mg/m2 matin et soir pendant 14 jours ou 625 mg/m2
matin et soir en continue.
Protocole entierement per os
TYVERB : en continu 5cp/jour en 1 seule prise au moins 1h avant ou après les repas au moment
dans la journée
XELODA : en discontinu → 2000mg/j/m² pendant 14j puis arrêt de 7j en 2 prises/j espacées de 12h
au moment du repas ou dans les 30 minutes après avec de l’eau.
Cure de 21 jours
 6
6
1
/
6
100%