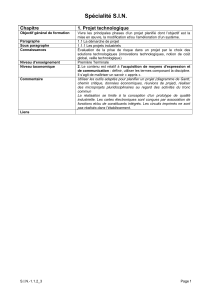
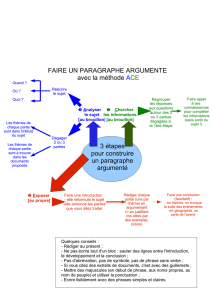
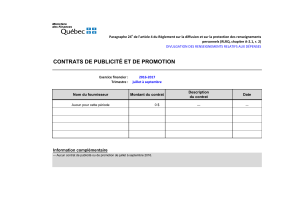
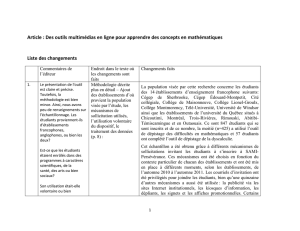
Referentenentwurf

État de traitement: 24/10/2016 16:38
1. ------IND- 2016 0570 D-- FR- ------ 20161122 --- --- PROJET
Projet de loi
du ministère fédéral de la santé
Projet de loi relatif à la mise à jour des dispositions relatives aux
préparations de sang et de tissus
A. Problème et objectif
Ce projet de loi a pour objectif d’apporter les modifications techniques et juridiques
nécessaires aux dispositions relatives aux préparations de sang et de tissus ainsi qu’aux
dispositions relatives aux médicaments de thérapie innovante afin de tenir compte des
progrès scientifiques et techniques actuels et des expériences acquises par les Länder et
par l’Institut Paul-Ehrlich lors de l’exécution de ces dispositions.
B. Solution
Ce projet de loi révise la procédure d’autorisation selon l’article 4b, de la loi sur les
médicaments (AMG), pour les médicaments de thérapie innovante (ATMP). La définition
de la notion de «préparation ponctuelle» énoncée à l’article 4b, paragraphe 2, de l’AMG,
est adaptée en tirant parti des expériences passées. Des informations et des documents
complémentaires doivent être fournis en plus des documents mentionnés à l’article 21a,
paragraphes 2 et 3, de l’AMG, pour les demandes d’autorisation selon l’article 4b,
paragraphe 3, de l’AMG.
La procédure d’autorisation applicable aux ATMP qui se composent d’organismes
génétiquement modifiés (OGM) ou en contiennent est simplifiée. À l’avenir, par analogie
avec la règlementation relative aux essais cliniques effectués avec les médicaments
contenant des OGM (article 9, paragraphe 4, du règlement sur les bonnes pratiques
cliniques - GCP) l’autorisation délivrée selon l’article 4b, de l’AMG, par l’Institut Paul-
Ehrlich couvrira également l’autorisation selon la loi sur le génie génétique.
Les modifications importantes des conditions qui sont à la base d’une autorisation selon
l’article 4b, de l’AMG, ne sont pas actuellement pleinement prises en compte dans la loi.
La procédure concernant les modifications des documents est désormais réglée de
manière spécifique à l’article 4b, de l’AMG.
Les documents à présenter pour une demande selon l’article 21a, paragraphe 1, de
l’AMG, sont également précisés sur la base des expériences acquises par l’Institut Paul-
Ehrlich lors de l’exécution de la disposition. La procédure concernant la modification des
documents est plus détaillée.
Les règles d’hémovigilance et de vigilance relatives aux tissus selon l’article 63i, de
l’AMG, sont uniformisées et précisées. Les règles d’hémovigilance sont étendues aux
préparations de tissus soumises à agrément selon l’article 21, de l’AMG, et donc jusqu’ici
aux règles de pharmacovigilance énoncées aux articles 63 et suivants de l’AMG. Une
clarification rédactionnelle est en même temps fournie pour les préparations de cellules
souches hématopoïétiques pour lesquelles l’article 63i, de l’AMG, s’applique déjà. La
procédure d’hémovigilance et de vigilance relative aux tissus, notamment pour les
établissements de tissus, est ainsi simplifiée.

- 2 - État de traitement: 24/10/2016 16:38
Les dérogations à l’interdiction de circulation prévues dans le décret relatif aux
médicaments radiopharmaceutiques ou traités par des rayonnements ionisants
conformément à l’article 7, paragraphe 1, de l’AMG, pour les médicaments dont la
fabrication a nécessité l’utilisation de rayonnements ionisants, sont étendues à
l’autorisation visée à l’article 4b, paragraphe 3, de l’AMG, et à l’article 21a, paragraphe 5,
de l’AMG.
Pour améliorer la transparence et la thérapie lors du traitement de patients souffrant
d’hémophilie à l’aide de préparations de facteurs, il est introduit dans la loi sur la
transfusion sanguine (TFG) et dans le décret relatif à la loi sur la transfusion sanguine une
base juridique pour le registre allemand de l’hémophilie. Les médecins chargés du
traitement de l’hémophilie sont tenus de communiquer au registre de l’hémophilie les
informations qu’ils détiennent sur les personnes souffrant de troubles de l’hémostase
d’origine congénitale.
En outre, différentes modifications rédactionnelles et techniques doivent être effectuées
dans l’AMG, la loi sur la transplantation, le décret sur la fabrication de médicaments et de
principes actifs et le décret relatif aux exigences de qualité et de sécurité en matière de
prélèvement des tissus et à leur greffe selon la loi sur la transplantation.
Les modifications de ce projet de loi concernent dans l’ensemble les lois et les décrets
suivants:
Article premier - Loi sur les médicaments;
Article 2 - Loi sur la transplantation;
Article 3 - Loi sur la transfusion;
Article 4 - Décret relatif à la fabrication de médicaments et de principes actifs;
Article 5 - Décret relatif aux exigences de qualité et de sécurité en matière de prélèvement
des tissus et à leur greffe selon la loi sur la transplantation;
Article 6 - Décret relatif aux médicaments radiopharmaceutiques ou traités par des
rayonnements ionisants;
Article 7 - Décret relatif à la procédure de notification selon les articles 21 et 22, de la loi
sur la transfusion.
C. Alternatives
Aucune.
D. Dépenses budgétaires sans charges d’exécution
L’état fédéral, les Länder et les communes ne doivent assumer aucune charge financière.
E. Charges d’exécution
E.1 Charges d’exécution pour les citoyens
Aucune charge d’exécution n’est justifiée, modifiée ou réduite pour les citoyens.

- 3 - État de traitement: 24/10/2016 16:38
E.2 Charges d’exécution pour le secteur économique
Il en résulte une charge d’adaptation unique de l’ordre de 308 000 euros et une charge
d’exécution annuelle de l’ordre de 1 011 000 euros pour le secteur économique.
La compensation nécessaire selon la règle du «One in, One out» du gouvernement
fédéral peut être fournie par les projets déjà achevés.
Les charges d’exécution incluent 20 obligations d’information nouvelles ou modifiées
assorties de frais administratifs annuels d’environ 1 011 000 euros.
E.3 Charges d’exécution pour l’administration
Il en résulte une charge d’adaptation unique au niveau fédéral d’environ 195 000 euros
pour l’administration. Il en résulte en outre une charge d’exécution annuelle à hauteur
d’environ 115 000 euros. Ces coûts sont entièrement supportés par l’État fédéral. Aucune
charge d’exécution n’incombera aux communes et aux Länder. Les besoins
supplémentaires, le cas échéant, en ressources matérielles et humaines dans le domaine
fédéral doivent être compensés sur le plan financier et en termes d’emplois dans la
section budgétaire respective.
F. Autres coûts
Aucune incidence sur les prix individuels n’est à signaler. Toute incidence sur le niveau
général des prix ainsi que sur le niveau des prix à la consommation est donc exclue.
Aucun impact sur les dépenses d’assurance maladie obligatoire n’est à signaler étant
donné la faible part qu’elles représentent dans les coûts totaux, d’autant plus qu’il est fort
probable qu’une amélioration des preuves de la thérapie entraine une réduction des
dépenses.

- 4 - État de traitement: 24/10/2016 16:38
Projet de loi du ministère fédéral de la santé

- 5 - État de traitement: 24/10/2016 16:38
Projet de loi relatif à la mise à jour des dispositions relatives aux
préparations de sang et de tissus
1
)
2
)
du ...
Le Bundestag a adopté la loi suivante:
Article premier
Révision de la loi sur les médicaments
La loi sur les médicaments, dans la version publiée le 12 décembre 2005 (Journal
officiel de la République fédérale d’Allemagne I, p. 3394), modifiée en dernier lieu par
l’article 4, paragraphe 11, de la loi du 18 juillet 2016 (Journal officiel de la République
fédérale d’Allemagne I, p. 1666), est modifiée comme suit:
1. Après la mention relative à l’article 142a, les mentions suivantes sont insérées dans
le sommaire:
«Article 142b - Disposition transitoire en vertu de la loi relative à la mise à jour des dispositions relatives aux
préparations de sang et de tissus“».
2. L’article 4b est modifié comme suit:
a) Les paragraphes 2 et 3 sont remplacés par les paragraphes 2 à 10 suivants:
(2) «sont préparés de façon ponctuelle au sens du paragraphe 1, phrase 1,
point 2, notamment les médicaments,
1. qui sont préparés ou utilisés de façon si limitée qu’il ne faut pas s’attendre à
ce qu’une expérience clinique suffisante soit acquise pour permettre
l’évaluation exhaustive de ce médicament, ou
2. qui n’ont pas encore été préparés et utilisés en nombre suffisant, de telle
sorte qu’il n’a pas encore été possible d’obtenir les connaissances
nécessaires pour leur évaluation.
(3) Les médicaments visés au paragraphe 1, phrase 1, ne peuvent être
remis à des tiers que s’ils ont été autorisés par l’autorité fédérale supérieure
compétente. L’article 21a, paragraphe 2, phrase 1, paragraphes 3 à 6 et 8,
s’applique par analogie. En plus des informations et des documents visés à
l’article 21a, paragraphe 2, phrase 1, la demande d’autorisation doit être
accompagnée des informations et des documents suivants:
1
) Notifié conformément à la directive (UE) 2015/1535 du Parlement européen et du Conseil du
9 septembre 2015 prévoyant une procédure d'information dans le domaine des réglementations
techniques et des règles relatives aux services de la société de l'information (JO L 241 du 17.9.2015,
p. 1)
2
) L'article 4, points 1 et 3, lettre b), permet la transposition de la directive (UE) 2015/566 de la
Commission du 8 avril 2015 portant application de la directive 2004/23/CE en ce qui concerne les
procédures de vérification des normes équivalentes de qualité et de sécurité des tissus et cellules
importés (JO L 93 du 9.4.2015, p. 56)
L'article 4, points 8 et 9, permet la transposition de la directive (UE) 2015/565 de la Commission du
8 avril 2015 portant modification de la directive 2006/86/CE en ce qui concerne certaines dispositions
techniques relatives à la codification des tissus et cellules humaines (JO L 93 du 9.4.2015, p. 43).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
1
/
63
100%