2. Les corécepteurs (CD4 et CD8)

Immunologie – E. Treiner.
Cours d’Inès Masmoudi. DCEM1 2010-2011.
LYMPHOCYTES T
- Acteurs essentiels de la réponse immunitaire adaptative contre les pathogènes intracellulaire.
- Pathologie : le déficit en LT à l’origine d’infection grave virale et opportunistes. Seul traitement
de ces enfants (« bébés bulles ») est la greffe de moelle.
- LT est composé par deux molécules : le récepteur à l’antigène (TCR) + le module de transduction
(CD3).
o LT TCR γδ: cytotoxicité ++, cytokines/chimiokines++.
Immunité des muqueuses, type innée.
o LT TCR αβ représente plus de 90% des LT sanguins.
o CD8 : cytotoxicité +++ et production de cytokines/chimiokines.
o CD4 : production cytokines/chimiokines et cytotoxicité. Ce sont des LT axillaires
qui orchestrent la réponse immunitaire.
- Reconnaissance de peptides d’origine microbienne, présentés par des molécules du CMH de
classe I ou de classe II.
I. Marqueurs des LT
- Spécifique :
o CD3.
o TCR (αβ ou γδ).
- Plus ou moins spécifiques (exprimé essentiellement par les LT mais pas uniquement):
o Les corécepteurs : CD4 ou CD8.
o CD5.
- Non spécifiques :
o CD2.
o LFA-1.
o CD45.
- Activation/différenciation :
o CD69.
o CD25 (IL-2Rα).
o CD45RA/CD45RO.
1. Module de transduction (CD3)
- Le TCR possède une courte portion intra cytoplasmique qui n’a pas de fonction dans la
transduction du signal. C’est pourquoi le TCR est toujours associé au CD3.
- Le CD3 est une molécule polymérique toujours associée au TCR (que ce soit αβ ou γδ).
o Composée de CD3γ, CD3, CD3(2) et CD3(2).
o Associée au TCR par des charges négatives (TCR chargé positivement).
Domaines extra et intracellulaire comprenant des motifs ITAM (Immunoreceptor
Tyrosine-based Activated Motif).
o Les motifs ITAM permettent al signalisation intracellulaire :

Immunologie – E. Treiner.
Cours d’Inès Masmoudi. DCEM1 2010-2011.
o L’agrégation des TCR par leurs ligands permettent la phosphorylation des résidus
tyrosines des ITAM par des kinases (associées aux corécepteurs), et l’association
à d’autres protéines kinase.
o Cela permet d’induire la cascade de signalisation.
- Principe général de fonctionnement des Immunorécepteurs :
o Lymphocytes T : TCR (CD3).
o Lymphocytes B : BCR (Igα et Igβ).
o Lymphocytes NK : NKG2D (DAP12).
2. Les corécepteurs (CD4 et CD8)
- L’affinité du TCR pour l’antigène est 1000 fois inférieure à celle des immunoglobulines (c'est-à-
dire : faible).
- L’interaction du TCR et de l’antigène n’est pas suffisante pour activer le LT.
- Nécessité de corécepteurs permettent une augmentation de l’avidité et de la signalisation.
- Les corécepteurs sont indispensables à l’activation des lymphocytes Tαβ : 99% des LT αβ
expriment soit CD4 soit CD8 (l’expression d’une des molécules est exclusive).
- La molécule CD4 :
o LTαβ expriment a 60% le CD4.
o Capable de e lier au domaine β2 du CMH II.
o Elle n’est pas totalement spécifique des LT : macrophages et dendritiques peuvent
l’exprimer minoritairement.
- La molécule CD8 :
o LTαβ(40%).
o Capable de se lier au domaine α2 du CMH I.
o Elle n’est pas totalement spécifique des LT, elle peut être exprimé minoritairement par :
les lymphocytes NK, les LTγδ et les cellules dendritiques. Quand ces cellules l’expriment
elles expriment un homodimère CD8αα.
- Ces molécules sont capables d’activer une Src kinase (rôle de transduction du signal).

Immunologie – E. Treiner.
Cours d’Inès Masmoudi. DCEM1 2010-2011.
- Les LT CD8+ sont spécifiques de peptides présentés par du CMH I.
- Les LT CD4+ sont spécifiques de peptides présentés par du CMH II.
- Mode d’action :
o Après une 1ère interaction entre TCR-CMHpeptide. Il y a une modification de la
conformation de la molécule CD4.
o CD4 va ainsi approcher le CMH classe II.
o La protéine Lck (associée au CD4) et la protéine CD3 (associée au TCR) sont mise en
contact. Cela permet la phosphorylation des motifs ITAM du CD3 et cascade de
signalisation.

Immunologie – E. Treiner.
Cours d’Inès Masmoudi. DCEM1 2010-2011.
- L’activation du LT utilise une organisation spatiale particulière des molécules impliquées :
radeaux lipidiques : ségrégation spatiale de certaines molécules dans la membrane cellulaire.
- Mise en place d’une synapse immunologique: Complexe supramoléculaire d’activation (SMAC).
o Ségrégation dans le SMAC des protéines extra-et intracellulaire impliquées dans
l’activation.
o Ségrégation hors des SMAC de molécules inhibitrices.
o Augmentation de l’avidité fonctionnelle, et polarisation de la sécrétion de
cytokines/granules.
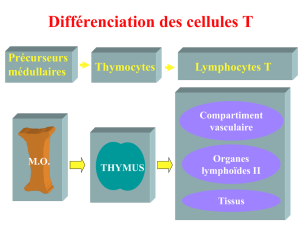
II. Développement des lymphocytes T
1. Moelle osseuse
- Cellule souche hématopoïétique (CD34+) se différencie :
o CFU-GEMM : précurseur de la lignée érythroblastique, mégacaryocyte et myélocyte.
o Progéniteur lymphoïde (parfois appelé précurseur lymphoïde commun).
- Ce progéniteur lymphoïde peut :
o S’orienter vers un précurseur T-NK.
o S’orienter vers la lignée B.
- Le précurseur T-NK peut :
o Soit s’engager vers la voie de développement de lignée T.
o Soit s’engager vers la voie de développement de la lignée NK.

Immunologie – E. Treiner.
Cours d’Inès Masmoudi. DCEM1 2010-2011.
2. Thymus
- La particularité des LT par rapport aux autres cellules hématopoïétique, tout le développement
restant des LT se produit dans un organe particulier qui lui ait dédié : le thymus.
- Ces étapes de différenciation sont sous le contrôle de facteurs de transcription :
o NUTCH1 pour la voie de différenciation des lymphocytes T (et non en LB).
o Icaros, CI, 4A3, etc.
- Les lymphocytes T se développent exclusivement dans le thymus.
o Thymocytes immatures va au cours des différentes étapes génèrent des thymocytes
matures.
o Ces thymocytes matures génèrent eux-mêmes des lymphocytes T.
o Les différentes étapes de développement sont intimement liées au réarrangement des
gènes TCR.
- Thymocytes immatures subit de nombreuses étapes de différenciation :
o Expression du TCR et CD3 :
o Réarrangement des gènes du TCR.
o Différenciation LTαβ ou LTγδ.
o Sélection positive et négative (éducation thymique).
o Acquisition du CD4 et CD8.
- Thymocytes double-négatif :
o Tiens son nom du fait qu’il n’exprime ni CD3 ni CD4 : CD3- CD4- CD8-.
o 4 stades (DNA, 2, 3 et 4) selon CD44/CD25.
- Les lymphocytes Tγδ :
o CD3+ CD4- CD8-.
o Le réarrangement γδ est fait en premier : les LT γδ sont exprimés plus précocement.
o Lorsqu’il y a une recombinaison de la chaine α il n’y a plus possibilité t’exprimé une
chaine γ (cf. cours précédent).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%