Ronéo - Free

1
Cours de Bactériologie n°4
Pr Bingen
Vendredi 10 octobre 2008 à 10h30
Ronéotypé par Diane-Cécile Gauthier
ANTIBIOTIQUES :
MECANISMES D’ACTION ET
DE RESISTANCE

2
I INTRODUCTION
A. Définition
B. Rappel : la structure bactérienne
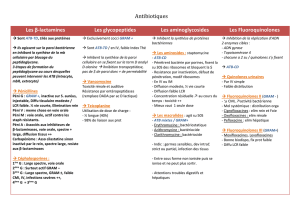
II LES DIFFERENTES CLASSES D’ANTIBIOTIQUES ET LEUR MODE D’ACTION
A. Antibiotiques inhibant la synthèse de la paroi bactérienne = Inhibiteurs de la synthèse du
peptidoglycane
1. Bêta-lactamines
1.1. Pénicillines
1.1.1) Pénicilline G (injection) et pénicilline V (voie orale)
1.1.2) Pénicilline M
1.1.3) Pénicilline A
1.1.4) Carboxypénicilline
1.1.5) Uréidopénicilline
1.1.6) Pénicilline + inhibiteur de pénicillinase
1.2. Céphalosporines
1.2.1) C1G et C2G
1.2.2) C3G
1.3. Carbapénèmes
2. Glycopeptides
B. Antibiotiques inhibant la synthèse protéique (ribosomes)
1. Aminosides
2. Macrolides, lincosamides et streptogramines (MLS)
3. Cyclines
4. Phénicolés
C. Antibiotiques inhibant la synthèse des acides nucléiques
1. Inhibition de la synthèse des folates
2. Inhibition de l’ADN gyrase
2.1) Quinolones
2.1)1. 1ère génération
2.1)2. Fluoroquinolones
« Anciennes FQ »
« Nouvelles FQ »
3. Inhibition de la transcription de l’ADN par fixation sur l’ARN polymérase ADN-dépendante
D. Récapitulatifs
III LES ANTIBIOTIQUES DANS LA PRATIQUE
A. Mesure de l’activité d’un antibiotique : CMI
B. Sensibilité et résistance
C. Antibiogramme et CMI
D. Mesure précise de la CMI
E. Les critères de choix des antibiotiques
F. Le rôle du laboratoire
Diapos sur le site : http://dcem1p7.free.fr

3
I INTRODUCTION
En France, nous sommes les champions d’Europe de l’usage des antibiotiques. Nous consommons 2 fois plus
d’antibiotiques que la Hollande. La consommation d’antibiotiques en France est surtout liée à des
infections respiratoires, qui sont le plus souvent virales. Aujourd’hui peu d’antibiotiques (à cause des
phénomènes de résistance), il faut donc les préserver lorsque cela est extrêmement nécessaire.
A. Définition
Un antibiotique est un dérivé produit par le métabolisme de microorganismes, possédant une activité
antibactérienne à faible concentration et n’ayant pas de toxicité pour l’hôte. Cette notion a été
étendue aux molécules obtenues par hémisynthèse (par l’industrie pharmaceutique).
Les cibles d’activités sont des structures moléculaires spécifiquement particulières, c'est-à-dire que
chaque famille d’antibiotiques agit sur une cible particulière, leur procurant une toxicité sélective pour les
cellules procaryotes et une toxicité faible pour les cellules eucaryotes.
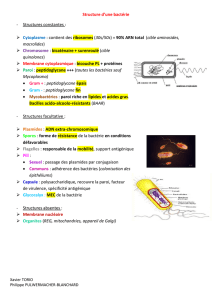
B. Rappel : la structure bactérienne
Une bactérie est constitué de :
- une paroi,
- un chromosome bactérien,
- un ou des plasmide(s) (pas obligatoirement),
- des ribosomes,
- des ARN polymérase ADN dépendante,
- des Gyrases.
En microbiologie, après coloration, on distingue 2 différents types de parois : Gram + et -. C’est
important de connaître cette différence pour choisir les traitements adéquats. Par exemple, les
streptocoques (Cocci gram- en chaînette) ou les staphylocoques (Cocci gram + en amas) ont des
traitements antibiotiques optimaux :
- La paroi des Gram + est constituée essentiellement de peptidoglycanes qui vont surmonter une
membrane cytoplasmique.
- La paroi du Gram – a aussi des peptidoglycanes et une membrane externe phospholipidique avec
des canalicules remplis d’eau = porines (passage de molécules hydrosolubles).

4
Le peptidoglycane permet la structure, la solidité et la forme de la bactérie. Il est constitué de chaînes
de N-acétyl muramique et N-acétyl glucosamique reliées entre elles par des peptides.
II LES DIFFERENTES CLASSES D’ANTIBIOTIQUES ET LEUR MODE D’ACTION
On distingue plusieurs classes d’antibiotiques :
• Beta-lactamines (ex : Pénicilline),
• Macrolides et apparentés (ex : Erythromycine),
• Aminosides (ex : Gentamycine),
• Fluoroquinolones (ex : Ciprofloxacine),
• Glycopeptides (ex : Vancomycine, Teicoplanine),
• Anti-tuberculeux.
Flagelle
Paroi +/- capsule
ADN
Génomique
ARNm
Ribosomes
plasmide
Peptidoglycane
Mbne externe
Porine
PLP
Mbne plasmique
Gram -
Ribosome
ARN- polymérase
ADN
ARN
Gyrase
Gram +
Nucléotides
Folates
Gram +
D Ala-D Ala
Peptidoglycane

5
A. Antibiotiques inhibant la synthèse de la paroi bactérienne = Inhibiteurs de la synthèse du
peptidoglycane
1. Bêta-lactamines
Mécanismes d’action :
Les -lactamines agissent sur les Gram + et Gram -. La cible des -lactamines est une enzyme : la
transpeptidase (indispensable à la synthèse de peptidoglycane).
Par exemple, la pénicilline et la céphalosporine sont des -lactamines qui ont un noyau -lactane. La
transpeptidase est sur la face externe de la membrane interne cytoplasmique. Pour que la -lactamine
agisse, elle doit se fixer physiquement avec une forte affinité sur sa cible (vrai pour tous les
antibiotiques).
Les -lactamine, pour agir, doivent se fixer sur les PLP (protéines liant les pénicillines), elles doivent donc
rentrer dans la cellule par la paroi. Dans le cas des Gram +, elles se fixent sans difficulté. Pour les Gram -,
les -lactamines sont des molécules hydrosolubles, donc elles traversent la porine pour entrer dans la
cellule et aller dans l’espace periplasmique pour se fixer sur le PLP. Il y a, à ce moment là, un arrêt de la
synthèse du peptidoglycane (bactériostase) et un éclatement de la bactérie (bactéricidie).
+
Inhibition de la pyruvyl-
transférase cytoplasmique, qui
permet la formation d’acide N-
Acétyl Muramique.
Fosfomycine
+
Fixation sur le dipeptide terminal
D-Ala-D-Ala du disaccharide
pentapeptide empêchant, par
encombrement stérique, l’action
des transglycosylases.
Glycopeptides
+
Inhibition des PLP (activité
transpeptidase), par analogie
structurale du cycle B-lactame
avec le dipeptide terminal D-Ala-
D-Ala du précurseur
disaccharide-pentapeptide.
-lactamines
Inhibition de la synthèse du
peptidoglycane
BACTERICIDIE
BACTERIOSTASE
MECANISMES
ANTIBIOTIQUES
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%