Physiologie PHYSIO 014 27/10/05 L`articulation scapulo

Physiologie
PHYSIO 014 27/10/05
L’articulation scapulo-humérale relie l’humérus à l’omoplate.
Mouvement d’antépulsion : le bras se porte en avant.
Mouvement de rétropulsion : le bras se porte en arrière.
Mouvement d’impulsion : il se rapproche du tronc.
L’articulation du coude : articulations huméro-cubitales et huméro-radiales. On trouve des
mouvements de flexion de l’avant bras sur le bras. Dans le mouvement de flexion, l’avant
bras est arrêté par la rencontre avec le bras. Son extension est limitée par la tension des
ligaments. Les mouvements des 2 os de l’avant bras sont dits de pronation et de supination.
- Pronation : le radius pivote sur le condyle de l’humérus, se met en croix avec le
cubitus et montre le pouce en dedans.
- Supination : mouvement de rotation ouverte : le radius reprend sa position et porte le
pouce en dehors et la paume de la main en avant
Ces mouvements se font en haut dans l’articulation huméro-radiale et en bas dans
l’articulation radio-cubitale. Ces 2 mouvements sont complétés par des mouvements dans
l’articulation de l’épaule (rotation de l’humérus qui fait tourner le cubitus en sens inverse du
radius.
2) Les membres inférieurs
Le squelette de la hanche est constitué de la ceinture pelvienne, d’os iliaque ou coxal. Les 2 os
iliaques sont réunis en avant sur la ligne médiane par la symphyse pubienne et en arrière ils
sont soudés au sacrum. L’os coxal est plat et sur le plan embryonnaire il est formé à partir de
3 os : l’ilion en haut avec la crête iliaque (sailli de la hanche), l’ischion (en bas et en arrière) et
le pubis (en bas et en avant), ces 2 derniers limitant le trou ischo-pubien. Cet orifice est le trou
obturateur. A la soudure des 3 os il y a la cavité cotyloïde dans laquelle s’engage la tête du
fémur.
3) Les articulations des membres inférieurs
L’articulation sacro-iliaque unis l’iliaque du bassin à la colonne vertébrale. Les
mouvements sont de faible amplitude pour la bascule du sacrum par lequel la partie
haute se porte en avant et le coccyx en arrière. L’amplitude augmente au cours de la
grossesse. L’articulation entre le pubis est une amphiarthrose (immobile) sauf en fin
de grossesse. Toutes les articulations des membres inférieurs sont des diarthroses.
L’articulation de la hanche : coxo-fémorale qui possède une surface articulaire
sphérique et une capsule articulaire de maintien (ce maintien étant fait également par
les ligaments et muscles péri articulaires ainsi que la pression atmosphérique). Il y a
différents types de mouvements pour cette articulation : 1) Mouvement de flexion
(face antérieure se rapprochant de la paroi abdominale) ; 2) Mouvement d’extension
(inverse) ; 3) Mouvement d’adduction ; 4) Mouvement d’abduction ; 5) Mouvement
de rotation.
L’articulation du genou : fémoro-tibiale et fémoro-rotulienne : Chaque condyle
fémoral s’articule avec une des cavités glénoïdes du plateau tibial. La concordance des

surfaces articulaires est obtenue par un ménisque. Les mouvements sont de flexion et
d’extension. Pour la flexion de la face postérieure de la jambe se rapproche de la
cuisse et elle s’en écarte lors de l’extension. Lors d’une stature de demi flexion, il peut
y avoir une légère rotation qui peut être à l’origine d’accidents articulaires.
L’articulation péronio-tibiale supérieure et inférieure : cette articulation n’effectue
que de très légers mouvements comme l’écartement des 2 os (tibia et péroné) en cas de
flexion du pied sur la jambe.
L’articulation tibio-tatienne : relie le tibia au pied, les mouvements sont de flexion
et extension uniquement. Ils rapprochent la face supérieure et antérieure de la jambe
pour la flexion et les écartes pour l’extension. L’axe est celui de la polyastragalienne.
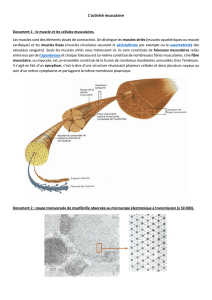
Le système musculaire
1) Composition globale
On distingue 3 grandes catégories de muscles basés sur les caractéristiques des cellules qui
constituent ce muscle.
- Cellules musculaires lisses : artères, veines, tube digestif…
- Cellules musculaires striées myocardiques : muscle cardiaque.
- Cellules musculaires striées squelettiques : dans les muscles liés au déplacement
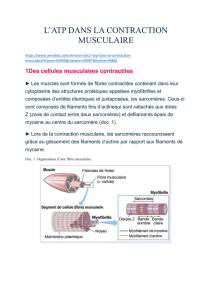
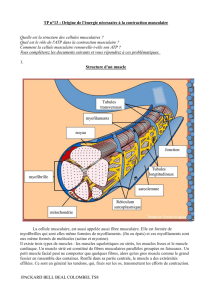
Les cellules des muscles striés : cellules allongées, forme cylindrique, longueur de quelques
millimètres à plusieurs centimètres selon la longueur des muscles et de diamètre variant de 10
à 100 micromètres. Ces cellules sont polynucléaires et chaque noyau contient 1 à 2 nucléoles.
Le noyau se trouve en périphérie et est de forme allongée. La membrane plasmique est
appelée sarconème. Le cytoplasme est appelé sarcoplasme et est formé de matériel protéique
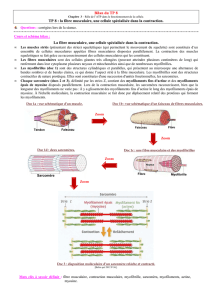
contractile qui forme les myofilaments (groupés en myofibrilles). Ces myofibrilles sont des
cylindres allongés dans le sens de la cellule et sont de même longueur que celle-ci. Elles ont
un diamètre d’1 micromètre. Chaque myofibrille peut être divisé en plusieurs cylindres
identiques (sarcomères). Chacun de ces sarcomères est délimité par un disque Z aux
extrémités. Le disque Z constitue un réseaux de myofilaments de 2 types : des épais (de
myosine) et des fins (d’actine). La répartition dans le sarcomère détermine des régions
structurelles différentes rendant compte de la striation périodique transversale des
myofibrilles.
- Les myofilaments épais : 1.5 micromètre de longueur sont au milieu du sarcomère
(bande ou disque A). Ce sont les disques sombres des sarcomères.
- Les myofilaments fins : ils sont disposés aux extrémités.
Les 2 myofilaments déterminent le disque ou la bande I (liaison de 2 sarcomères). Les disques
I sont clairs. Les disques Z marquent la limite des sarcomères par l’endroit d’interpénétration
des filaments fins. A leurs extrémités, les myofilaments fins et épais se chevauche ce qui
détermine au centre du disque A, le disque H qui ne tient compte que des filaments épais. Au
centre du disque H, il y a la ligne M : renflement médian des myofilaments épais. Pendant la
contraction, il y a des ponts d’union entre les myofilaments épais et fins. Il existe aussi la
mébuline (aligne l’actine) et la titine (élasticité et stabilité de la myosine). Une mauvaise
synthèse de ces protéines peut être à l’origine de problèmes cardiaques.

Le sarcoplasme est un système très performant (réticulum endoplasmique lisse), réticulum
sarcoplasmique : système longitudinal de réseaux de canalicules qui entourent les myofibrilles
et se résolvent en citernes terminales entre les disques A et I.
Le système T : système transversal de canalicules, étroit et fermé par des invaginations du
sarconème. Il entoure les myofibrilles à chaque jonction entre 2 citernes terminales (disques A
et I). L’ensemble du tubule de système T + les 2 citernes s’appelle une triade.
Les organites habituels des cellules se trouvent dans ce type de cellules ainsi que des
enzymes, de l’ATP, de la myoglobine, des gouttelettes lipidiques (acides gras) et du
glycogène. Ils sont revêtus par une membrane basale.
Les microfilaments sont dans toutes les cellules. Dans les muscles squelettiques il y a de la
myofibrille et la contraction de celle-ci résulte du glissement des filaments les uns sur les
autres. Les protéines jouent une action réciproque (actine et myosine).
L’actine C : polypeptide (41800 daltons) stabilisé sous forme globulaire grâce à un ion
calcium. Chaque molécule d’actine C possède une molécule d’ATP qui va être hydrolysée
lorsque l’actine C va se polymériser pour former de l’actine F. L’hydrolyse de l’ATP va
augmenter la vitesse de polymérisation de l’actine C. Les filaments d’actine sont fait ainsi : 2
chaînes de molécules globulaires enroulées entre elles en hélices (13.5 molécules par tour
d’hélice). Ces filaments forment la tropomyosine. Cette tropomyosine est rigide, se loge dans
les gorges formées par la double hélice d’actine. Au repos elle occupe des sites de l’actine
possédant une forte affinité pour la myosine.
La troponine est composée de 3 complexes de polypeptides. Il y a la troponine C, la I et la T
qui sont associées à 7 molécules d’actine. La troponine C possède 1 site de liaison pour la
tropomyosine et serait responsable du positionnement de la troponine (qui fixe 4 atomes de
Ca) La troponine I inhibe l’interaction entre l’actine et la myosine.
La myosine : molécule (500000 daltons), 6 chaînes polypeptidiques dont 2 chaînes lourdes de
200000 daltons, chacune d’entre elle étant constituée d’un segment d’hélice alpha attaché à la
tête globulaire. La myosine comporte également 2 chaînes légères (de 20000 et 16000
daltons). Un exemplaire est attaché à la tête de la chaîne lourde. La myosine dégrade l’ATP,
activité stimulée par l’actine. Les molécules de myosine sont attachées par la queue et
quelques centaines sont attachées leur tête faisant sailli. La région centrale est dépourvue de
têtes. Dans les cellules non musculaires, l’assemblage dépend de la phosphorylation. Dans les
cellules musculaires lisses, il n’y a pas de troponine mais on trouve une protéine de même
nature fixant aussi le calcium : la calmoduline.
2) La contraction musculaire
Elle dépend de la fixation du calcium sur la troponine. Ce calcium vient du réticulum
sarcoplasmique. Il y a alors déplacement de la tropomyosine et libération des sites d’actine
qui possèdent une affinité pour la myosine. L’ATP en se liant à la tête de la myosine est
hydrolysée en ADP qui reste fixée. L’ADP est libérée et il y a alors rotation de la tête de
myosine (glissement de myofilaments). Puis une nouvelle ATP se fixe sur la tête de la
myosine. Il y a alors nouvelle hydrolyse de l’ATP et relâchement de la tête globulaire qui
revient à sa position initiale. Les 2 phénomènes (contraction et relâchement) nécessitent de
l’énergie quoi qu’il en soit.

1
/
4
100%