CIII

CIII SOLUTIONS ELECTROLYTIQUES ET CONCENTRATIONS
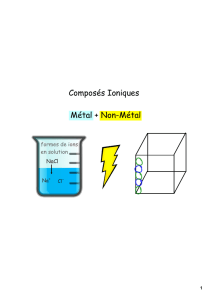
I) LES SOLIDES IONIQUES
1) Exemples
Le chlorure de sodium de formule ………… est formé d'ions ………. et ……… présents en même quantités :
Le fluorure de calcium de formule CaF2 est formé d'ions ……… et d'ions …….. deux fois plus nombreux
pour satisfaire la neutralité électrique de l’ensemble.
2) Conclusion
Un solide ionique, aussi appelé ……………. ionique est constitué d'ions positifs (………………..) et d'ions négatifs (……………..)
…………………….. dans l'espace.
Dans un solide ionique, l’attraction entre un ion et son plus proche voisin est assurée par l’interaction …………….…………… (loi de
……………………..).
Les cristaux ioniques sont ………………………………… …………………… et sont des …………………..
3) Formules et noms
a) Comment bien écrire la formule d’un solide ionique
On termine toujours la formule par l’indice (s) pour préciser que c’est un solide
On écrit le symbole du cation et de l’anion dans cet ordre sans noter leurs charges ; ex : NaCl(s)
On place des nombres entiers en indice des symboles pour respecter les proportions des ions dans le solide ; ex : CaCl2(s)
On met le symbole entre parenthèses si l’ion est polyatomique, puis l’indice si nécessaire ; ex : Cu(OH)2(s)
b) Comment nommer le solide ionique
On cite l’anion en premier, puis le mot « de » et ensuite le cation.
Exemples : Sulfate de cuivre : CuSO4(s) Chlorure de calcium : CaCl2(s)
Phosphate d’argent : Ag3PO4(s) Sulfate d’aluminium : Al2(SO4)3(s)
c) Application : compléter le tableau
Sulfate de sodium
Cu(OH)2
II) LE CARACTERE DIPOLAIRE DE CERTAINES MOLECULES
1) Exemple : la molécule de chlorure d'hydrogène
Les électrons du doublet liant entre H et Cl ont tendance à se rapprocher plus de l'atome Cl et à s'éloigner de l'atome H. On
dit que la liaison H-Cl est polarisée et que la molécule de chlorure d'hydrogène est ……………….., c'est-à-dire non
symétrique en terme de charges électriques.
On représente alors la molécule en faisant apparaitre des charges localisées + δ et – δ sur les atomes :
2) Electronégativité des éléments
L'électronégativité traduit la capacité d'un élément à attirer vers lui les électrons d'un doublet liant. Un élément qui a
cette tendance est dit électronégatif.
Par exemple, l'élément chlore est plus électronégatif que l'élément hydrogène, d’où les charges + δ et – δ notées ci-dessus.
Dans le tableau de Mendeleïev suivant, l’électroneutralité des éléments est croissante de gauche à droite et de bas en haut :
Une molécule est polaire si :
Elle possède au moins une liaison polarisée ; ex H-Cl
Le barycentre des charges positives +δ n’est pas confondu avec barycentre des charges négatives – δ ; ex ci-après
Eléments peu électronégatifs
H
Cl
O
+ δ représente une charge électrique positive
- δ représente une charge électrique négative

3) La molécule d'eau
L’élément Oxygène est plus électronégatif (noté – δ) que l’élément Hydrogène (noté + δ) (voir tableau ci-dessus) et attire
donc vers lui les électrons doublets liants qu’il possède avec l’hydrogène :
III) DISSOLUTION DES SOLIDES IONIQUES OU DES MOLECULES POLAIRES DANS L'EAU (voir TP C3)
1) Mécanisme
Les molécules d'eau, polaires, exercent sur un cristal ou une autre molécule polaire des forces électriques qui les
« détruisent ». Cette dissolution a lieu en 3 étapes (voir animation) :
Dissociation
Le solide ionique ou la molécule polaire, appelé soluté, se dissocient dans l’eau, appelée solvant. Ils forment des ions libres en solution.
Solvatation
Les molécules d'eau s'orientent sous l'action de forces d’interaction électriques qui existent entre les ions. On obtient donc des ions
solvatés par des molécules d’eau : ions hydratés..
Pour rappeler que les ions sont hydratés, on écrira (aq) en indice. Exemple : Na+(aq)
Dispersion
Les ions se dispersent dans la solution jusqu’à ce qu’elle soit homogène. On obtient alors une solution ionique appelée solution électrolytique.
2) Conduction électrique d’une solution ionique : voir TP C5
Une solution ionique conduit le courant électrique car elle contient des ions qui peuvent se déplacer.
Contre-exemple : eau sucrée = molécules de sucre dispersées dans l’eau
3) Cas particulier de l’ion hydrogène
L'ion H + est constitué d’un unique proton. Cet ion est très petit et forme avec l'eau une liaison très forte qui permet de le
considérer comme étant l'espèce H3O +, appelée ion oxonium. La solvatation de l'ion H + s'écrit : H + + H2O H3O +
RMQ : symboles possibles uniquement : H +(aq) ou H3O +
IV) FORMULES DES SOLUTIONS IONIQUES
1) Notations
2) Equation chimique de la réaction de dissolution
La dissolution est une transformation chimique modélisée par une équation où le solvant n’apparaît pas.
On indique l’état des composés par (s), (l) , (g) ou (aq) en indice.
Exemples (voir TP C3)
Dissolution dans l’eau :
Equation de la réaction
d’un solide ionique
NaCl(s) Na +(aq) + Cl -(aq)
d'un gaz (chlorure d'hydrogène HCl)
HCl (g) H +(aq) + Cl -(aq)
d'un liquide (acide sulfurique H2SO4)
H2SO4(l) 2 H +(aq) + SO4 2 - aq)
V) CONCENTRATIONS MOLAIRE
1) Concentration molaire en soluté apporté (le soluté est noté A)
Nom
Formule
solution aqueuse de chlorure de sodium
(Na +(aq) + Cl -(aq)) ou (Na ++ Cl -)(aq)
solution aqueuse de Sulfate d’aluminium
(2 Al 3+(aq) + 3 SO4 2-(aq)) ou (2 Al 3++ 3 SO4 2-)(aq)
C(A) = CA = n(A)
Vsolution
H
H
O
+
2 « - »
+
+ : charge partielle positive
- : charge partielle négative
H
H
O
+2
-2
Le barycentre des charges positives +2δ n’est pas
confondu avec barycentre des charges négatives – 2δ
Donc H2O est une molécule …………..

Exemple 1
On introduit 1,50.10-1 mol de sel de cuisine dans V = 500 mL d’eau.
Exemple 2
On dissout 0,10 mol de sulfate de sodium solide dans 1,0 L d'eau.
Déterminer la concentration molaire en soluté apporté dans cette solution.
C(NaCl) =
C(Na2SO4 ) =
2) CONCENTRATIONS MOLAIRES EFFECTIVES des espèces dissoutes
Ecrire l’équation de la réaction de dissolution du solide ionique l’eau pour les deux exemples précédents
Déterminer les concentrations molaires effectives des espèces dissoutes en considérant que tout le solide est dissout !
VI) PREPARATION DE SOLUTIONS IONIQUES
1) Préparation d’une solution par DISSOLUTION D’UN SOLIDE IONIQUE : voir TPC2 et C3
2) Préparation d’une solution par DILUTION D’UNE SOLUTION concentrée : voir TPC2
On veut préparer 100mL d’une solution de phosphate de potassium de concentration 50 mmol.L-1,à partir d’une solution
mère de concentration 1,00 mol.L-1.
Faire les calculs nécessaires et indiquer, à l’aide de schéma, le mode opératoire de cette préparation.
CONCLUSION
Pour une espèce chimique, notée X, dissoute en solution :
ATTENTION de ne pas confondre : concentration molaire de soluté apporté C(A) et concentration molaire effective
[X] d’une espèce en solution (cf. coefficients stœchiométriques dans l’équation de dissolution !)
[X] = n(X)
Vsolution
1
/
3
100%