2007-2008 -- ElHaouaria

CHIMIE (7pts):
I-/On mélange à t=0, dans un erlenmeyer un volume v1 = 50cm3 d’une solution aqueuse d’iodure de
potassium (K++I-) de concentration molaire C1 avec un volume v2=100cm3 d’une solution aqueuse de
peroxodisulfate de potassium (2K++S2O82-) de concentration molaire C2=0,1mol.L-1 .La température
maintenue fixe égale 25C°. Il se forme le diiode (I2) selon la réaction supposée totale
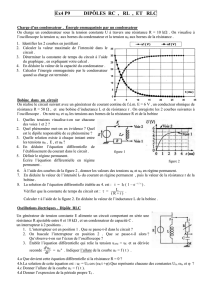
d’équation chimique: 2I- + S2O82- I2 + 2 SO42- La courbe de la figure -1- représente la variation de
la quantité de diiode I2 en fonction de temps
1-a) Dresser un tableau descriptif de l’évolution du système chimique (tableau d’avancement)
b) Déterminer en justifiant l’avancement final xf de la réaction.
c)-Montrer alors que les ions I- est le réactif limitant.
d) En déduire alors la concentration molaire C2 de la solution aqueuse d’iodure de potassium.
2)a) Déterminer l’avancement x de la réaction à la date t1= 20min.
b) En déduire la quantité de matière de chaque entité chimique présente dans le système à la date t1
3-a) Définir la vitesse instantanée de la réaction.
b) Déterminer en expliquant la méthode utilisé cette vitesse à t1 = 20 min .
II-/Dans le but d’étudier l’influence de certains facteurs cinétiques sur la vitesse moyenne de la réaction
des ions I- avec les ions S2O82- , on réalise les expériences suivantes :
On considère trois béchers (A) et (B) et (C), contenant chacun :
- un volume V1= 40mL d’une solution aqueuse (S1) d’iodue de potassium (K++I-) de concentration
molaire C1= 0,5mol.L-1,
- un volume V’=10mL d’une solution diluée d’empois d’amidon.
- un volume V0= 0,5 ml d’une solution aqueuse (s) de thiosulfate de sodium(2Na++ S2O32) de
concentration molaire C0 =0,2molL-1.
Au contenu du bécher (A), on ajoute quelques gouttes de sulfate de fer II,
Au contenu du bécher (B) on ajoute encore 20mL d’eau glacée.
le bécher (C) utilisé comme témoin
A l’instant t=0, on ajoute simultanément au mélange contenu dans chacun des trois béchers un
volume V2=10ml d’une solution de peroxodisulfate de potassium (2K++ S2O82-) de concentration
molaire C2= 0,05molL-1 et déclencher aussitôt le chronomètre.
On note, pour chaque système chimique, la durée
t
qui s’écoule entre l’instant initial et l’instant
d’apparition d’une coloration bleue noire.
Les résultats sont consignés dans le tableau ci-dessous :
bécher
(A)
(B)
( C)
t
(min)
0,5
0,9
0,6
1/ En faisant appel aux calculs nécessaires et aux conditions expérimentales
a-) Quels sont les différents facteurs cinétiques mis en jeu par ces trois expériences.
b-) Préciser leurs influences sur la vitesse de la réaction ?
Ministère de l’éducation
L.S.Haouaria
Devoir de contrôle N°1
Matière : Sc. Physiques
Classes : 4 M1 & 4Sc1-
Profs :
Mrs B Laroussi -Akkari.D
Date : 17/11/2007
Durée :2H

PHYSIQUE (13pts)
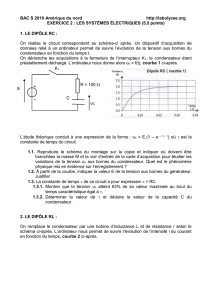
Exercice1 (6,5pts) : (charge et décharge d’un condensateur)
Le montage représenté par la figure-1- permet de charger le condensateur par un générateur de
Courant puis le décharger a travers une résistance R.
1 - Des deux graphes proposés dans les figures 3 et 4 dire en justifiant laquelle correspond à la charge
du condensateur ?
2- La charge du condensateur dure
t
= 40s et l’intensité du courant débité par le générateur du
courant a pour valeur I=10μA .
a)-Calculer la charge maximale du condensateur.
b) Déterminer la capacité C du condensateur.
c) Quelle est la valeur de l’énergie emmagasinée par le condensateur à la fin de la charge.
3- A l’instant initial le condensateur est chargé,on bascule alors l’interrupteur en position 2
a)- En appliquant la loi d’additivité des tensions, montrer que l’équation différentielle vérifiée par la
tension uc est de la forme :
0
1 c
cu
dt
du
, avec
une constante
que l’on exprimera en fonction des caractéristiques des différents
dipôles du circuit de décharge.
b)- Vérifier que la solution de cette équation différentielle est de la
forme :
t
ceAtu
)(
. Donner l’expression de A et
.
c - Déterminer en expliquant la méthode utilisée la valeur de la
constante de temps
. En déduire la valeur de la résistance R ?
d) Représenter en justifiant l’allure de la courbe de variation de i(t) .
Préciser sa valeur à t=0.
4. Faut-il augmenter ou diminuer la valeur de R pour décharger plus rapidement le condensateur?
Justifier la réponse.
Exercice2 (6,5pts); (Etude d’une bobine)
On se propose d’étudier les caractéristiques d’une bobine, à savoir son inductance L et sa résistance
interne r. Pour cela, on réalise le circuit comportant en série : la bobine , une résistance R = 50
, un
interrupteur K et un générateur de tension continue de force électromotrice E = 6V. On fait appel à un
oscilloscope à mémoire pour visualiser simultanément les tensions aux bornes du générateur et de la
résistance, après la fermeture de l’interrupteur. Voici l’oscillogramme représenté par la figure-5-
1-Faire le schéma du circuit et indiquer le branchement de l’oscilloscope
2-Attribuer à chaque courbe de la figure5 la tension visualisée sur la voie A puis sur la voie B
3-Quelle est celle qui permet d’étudier la variation de l’intensité i(t) du courant traversant la bobine.
4a) Etablir l’équation différentielle à laquelle obéit l’intensité i du courant dans le circuit. Montrer qu’elle
s’écrit :
TT R
E
i
dt
di
R
L
avec RT= R + r ;
b) La solution générale de cette équation différentielle est de la forme :
BeAti t
)(
ou A ;B et
sont des constantes qu’on demandera de déterminer leurs expressions en fonction des différents
paramètres de circuit.
5)a) Montrer qu’en régime permanent, le courant i tend vers une valeur constante I0 qu’on déterminera
sa valeur.
b) En déduire la valeur de r.
6) a) -A l’aide de l’oscillogramme, déterminer en expliquant la méthode utilisée (sur la feuille annexe) la
valeur de la constante de temps
b-En déduire la valeur de L
7-Déterminer l’énergie électrique emmagasinée dans la bobine lorsque le régime permanent est établit
8) Déterminer la valeur de la f.é.m d’auto- induction à l’instant t= 0s
Fig-2-

Feuille annexe.
0,2
0,4
0,6
0,8
t(min)
n(I2)(10-2mol-1)
10 20 30 40 50 60 70
1
0
Fig-1-
1
/
3
100%