EXERCICE 4 : GENERATEUR ELECTROMECANIQUE (4 points)

DEVOIR DE CHIMIE DE PREMIERE SCIENTIFIQUE - 2 HEURES
A RENDRE LE LUNDI 16 MAI
EXERCICE 1 : VERIFICATION DE LA CONCENTRATION D’UNE SOLUTION (4,5 points)
On prépare V = 1,0 L de solution de thiosulfate de sodium (2Na+ + S2O32-) en dissolvant une masse m = 15,82 g de
thiosulfate de sodium solide Na2S2O3 (s).
1) Calculez la concentration théorique Cth de la solution de thiosulfate de sodium. (1pts)
Données : M(Na) = 23,0 g.mol-1 ; M(S) = 32,1 g.mol-1 ; M(O) = 16,0 g.mol-1
On veut vérifier la concentration de cette solution en effectuant un dosage avec une solution de permanganate de
potassium (K+ + MnO4-) de concentration C1 = 0,020 mol.L-1.
Dans un bécher, on prélève un volume V = 20,0 mL de solution de thiosulfate de sodium. On remplit la burette
graduée avec la solution de permanganate de potassium. Le volume de solution de permanganate de potassium
versé à l’équivalence est : V1eq = 21,6 mL.
2) Quelle est l’espèce dosée ? Quel est le réactif titrant ? (0,5pt)
L’équation de la réaction qui se produit dans ce dosage est :
10 S2O32-(aq) + 2 MnO4-(aq) + 16 H+ 5 S4O62-(aq) + 2 Mn2+(aq) + 8 H2O
3) Définir ce qu’est l’équivalence d’un dosage. (0,5pt)
4) Comment dans cette expérience peut-on repérer le moment de l’équivalence ? Expliquez. (1pt)
5) Déterminer la concentration C de la solution de thiosulfate de potassium. (1pt)
6) Comparer la valeur de la concentration déterminée lors de ce dosage à la concentration théorique calculée au 1).
(0,5pt)
EXERCICE 2 : DOSAGE CONDUCTIMETRIQUE. (3 points)
On veut déterminer la concentration CA d’une solution
d’acide bromhydrique (H3O+ + Br –(aq)). On introduit
VA= 200,0 mL d’acide bromhydrique dans un bécher
avec un barreau aimanté. On dose cette solution à
l’aide d’une solution d’hydroxyde de potassium
(K+(aq)+HO–(aq)) de concentration CB=1,00 mol.L-1. La
solution d’hydroxyde de potassium est introduite dans
une burette graduée et on note V le volume versé.
La mesure de la conductance de la solution au cours
du dosage permet d’établir la courbe ci-contre :
1. Quelle est la réaction de dosage ? Ecrire son
équation. On donne les couples acide-base
H3O+/H2O et H2O / HO-(aq). (1pt)
2. Comment peut-on déterminer le volume VBE de
solution d’hydroxyde de potassium versé à
l’équivalence ? Le déterminer. (0,5pt)
3. Déterminer la concentration CA de la solution d’acide bromhydrique. (1,5pt)
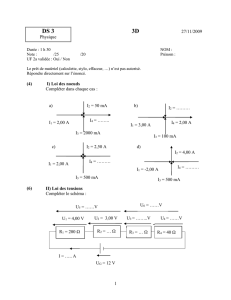
EXERCICE 3 : LES LOIS DE L’ELECTRICITE DANS UN CIRCUIT (3,5 points)
Le circuit électrique d’une voiture électrique miniature est schématisé ci-dessous. La tension UPN délivrée
par la pile est égale à 6,0 V. L’intensité I du courant délivrée par la pile est égale à 0,75 A.
1. Déterminer les valeurs des tensions UAB et UCD.
(0,5 pt)
2. Représenter sur le schéma la tension UCE, ainsi
que l’intensité i délivré par la pile. (0,5 pt)
3. Sachant que UCE = UEF = 2,0 V en déduire la
valeur de UFD. (1 pt)
4. La résistance du conducteur ohmique est de 18 Ω.
a. Quelle est l’intensité du courant qui traverse
ce conducteur ? (1 pt)
b. Quelle est celle du courant qui traverse le
moteur ? (0,5 pt)

EXERCICE 4 : GENERATEUR ELECTROMECANIQUE (4 points)
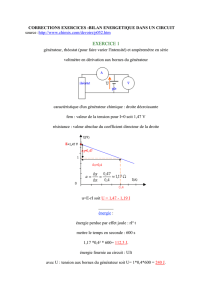
Un générateur électromécanique (comme une dynamo de vélo) maintient une tension UPN = 11,8 V lorsqu’il
assure le passage d’un courant d’intensité I = 5,2 A dans la portion extérieure du circuit. Les pertes par
effet Joule correspondent à 6,8 W.
1. Caractéristiques du générateur :
a. Quelle relation lie la puissance électrique dissipée par effet Joule et la résistance interne r du
générateur ? En déduire la valeur de r. (1pt)
b. Quelle relation lie la tension UPN et l’intensité I du courant délivré par le générateur. En
déduire, la f.é.m. de ce générateur. (1pt)
2. Ce générateur est un générateur électromécanique. Calculer l’énergie mécanique Wm fournie à ce
générateur, l’énergie électrique We fournie au circuit par le générateur et l’énergie WJ dissipée par
effet Joule pendant la durée Δt = 5 h 15 min de fonctionnement, dans les conditions indiquées.
(2pts)
EXERCICE 5 : CHARGEUR SOLAIRE. (5 points)
Un fabricant de chargeur solaire propose en ces thermes son produit sur l’Internet.
L’utilisation des appareils solaires et des batteries (piles rechargeables) évite
celui des piles ordinaires (non rechargeables) qui font grossir la masse des
déchets qui polluent dangereusement l’environnement.
Le chargeur solaire, photographié ci-contre, vous permet, avec tous ses
accessoires, de faire fonctionner près de 90% des petits appareils
électroniques requérants moins de 2 watts de puissance. Il fonctionne avec
des cellules photovoltaïques.
Puissance électrique fournie : 2,2 W.
Fonctionnement nominal : 290 mA ; 145 mA.
Avec un ensoleillement de 5h par jour, il peut fournir une énergie
comprise entre 8,8 et 11 W.h.
1. Pourquoi l’utilisation de ce chargeur contribue-t-elle activement à la protection de l’environnement ?
(0,5 pt)
2. Calculer les tensions nominales disponibles aux bornes de ce chargeur lors d’un fonctionnement
nominal. (1 pt)
3. Calculer, en joule, l’énergie équivalente à 11 W.h. (0,5 pt)
Une batterie Cd-Ni, de résistance interne 0,80 Ω, est rechargée avec un tel dispositif (elle se comporte alors
comme un électrolyseur) ; cette recharge se fait à intensité constante I = 290 mA sous la tension nominale
correspondante. La durée de la charge est évaluée à 4h.
5. Calculer l’énergie électrique fournie par le chargeur au cours de la charge. (1 pt)
6. Calculer l’énergie dissipée par effet Joule dans la batterie pendant la charge. (1 pt)
7. Calculer l’énergie stockée dans la batterie sous forme d’énergie chimique. (1 pt)
1
/
2
100%