Classe de BTS AB1 Chapitre 3 : Les liaisons faibles Chapitre de

Classe de BTS AB1
Chapitre 3 : Les liaisons faibles
Chapitre de Chimie n°3
Les liaisons faibles
I- Les liaisons de Van der Waals
Définition :
Remarque : Lorsqu'une molécule, est apolaire c'est-à-dire n'a pas de moment dipolaire, si elle se trouve près d'une molécule
polaire, la molécule apolaire peut être polarisée et donc devenir à son tour un dipôle, il peut alors y avoir une liaison de Van der
Waals entre la molécule polaire et la molécule polarisée
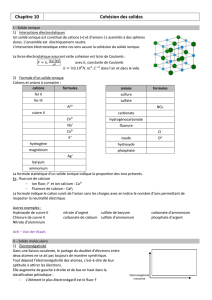
II- Les liaisons hydrogène
Définition :
Liaison hydrogène entre des molécules d'eau
Les liaisons hydrogène intermoléculaires Définition :
Par exemple, ce sont des liaisons hydrogène qui
maintiennent ensemble les deux brins de nucléotides qui
constituent l'ADN
Structure de L'ADN
Les liaisons hydrogène intramoléculaires
Définition :
Exemple : Acide maléique (ci-contre)
Remarque sur leur énergie :

Classe de BTS AB1
Chapitre 3 : Les liaisons faibles
Chapitre de Chimie n°3
Les liaisons faibles
I- Les liaisons de Van der Waals
Définition : Ce sont des liaisons électrostatiques de faible énergie (environ 10 kJ.mol-1). Elles résultent de
l'interaction entre les dipôles de moment dipolaires μ.
Elles sont majoritairement intermoléculaires, c'est-à-dire qu'elles se trouvent entre des molécules (et pas à
l'intérieur d'une molécule)
Remarque : Lorsqu'une molécule, est apolaire c'est-à-dire n'a pas de moment dipolaire, si elle se trouve près d'une
molécule polaire, la molécule apolaire peut être polarisée et donc devenir à son tour un dipôle, il peut alors y avoir
une liaison de Van der Waals entre la molécule polaire et la molécule polarisée
II- Les liaisons hydrogène
Une liaison hydrogène est toujours présente entre les
atomes N,O et F et l'hydrogène issu d'une liaison
comme N-H, O-H, F-H.
Les particularités de ces atomes sont : une forte
électronégativité, un rayon atomique petit et la présence
de doublets non-liants.
Liaison hydrogène entre des molécules d'eau
Les liaisons hydrogène peuvent être intermoléculaires : on en trouve entre des molécules d'eau, d'ammoniac, de
fluorure d'hydrogène, d'alcools...
Par exemple, ce sont des liaisons hydrogène qui
maintiennent ensemble les deux brins de
nucléotides qui constituent l'ADN
Structure de L'ADN

Classe de BTS AB1
Chapitre 3 : Les liaisons faibles
Elles peuvent également être intramoléculaires, c'est-à-dire exister à l'intérieur d'une même molécule.
C'est le cas par exemple pour l'acide maléique ci-contre, un diacide qui présente
une liaison hydrogène entre ces deux fonctions acides
Leur énergie est plus importante que celle des liaisons de Van der Waals, elle est
d'environ 30 kJ.mol-1.
Liaison hydrogène entre des molécules d'eau

Classe de BTS AB1
Chapitre 3 : Les liaisons faibles
Structure de L'ADN
Liaison hydrogène Liaison hydrogène
entre l'adénine et la thymine entre la guanine et la cytosine
1
/
4
100%