doc - nanomega

Physique 2nde Chap10 : L’état gazeux
Chapitre 10 : L’état gazeux
I. Description microscopique d’un gaz
1) Introduction : les 3 états de la matière
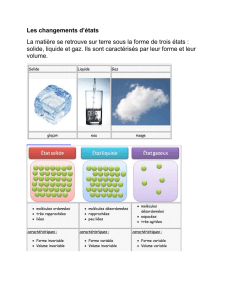
Il existe 3 états de la matière : l’état solide, l’état liquide et l’état gazeux.
Ces 3 états se présentent de manière différente au niveau macroscopique.
Dans l’exemple de l’eau : l’état solide est la glace, l’état liquide est l’eau liquide
et l’état gazeux est la vapeur d’eau.
Placé dans un récipient, le solide conserve sa forme propre, le liquide occupe la
partie basse du récipient et à une surface horizontale, le gaz occupe tout le
récipient.
Au niveau microscopique, les 3 états physique d’une même espèce chimique sont
composés des mêmes molécules (la glace, l’eau liquide et la vapeur d’eau sont
constituées de molécule d’eau H2O).
Ce qui différencie les 3 états de la matière est la proximité et le lien des
molécules entre elles :
solide : molécules ordonnées, en contact, peu mobiles et fortement liées
liquide : molécules en contact, assez mobiles et faiblement liées entre elles
gaz : molécules distantes, très mobiles et non liées entre elles
2) Expériences
a) Le mouvement des molécules d’un gaz :
On prépare un flacon contenant de l’air (gaz incolore) et un
deuxième flacon contenant du dioxyde d’azote (gaz orange).
On met en contact ces deux flacons et on observe que les
deux gaz se mélangent.
Interprétations et conclusions :
- Les molécules d’un gaz occupent tout le volume qui leur est offert.
- Les molécules qui composent un gaz sont en mouvement et se déplacent en
permanence dans toutes les directions : on parle d’agitation.
b) La distance entre les molécules d’un gaz :
On remplit un ballon de dioxygène (O2) et on le pèse. On fait ensuite le vide dans le
ballon et on le pèse à nouveau.
On calcule la masse de dioxygène contenu dans le ballon :
m gaz = m ballon plein – m ballon vide = ___________
On détermine le nombre de molécules de dioxygène dans le ballon :
N = m gaz / m molécule de dioxygène = __________
(m molécule de dioxygène = 2 x 16 x mnucléon = 5,3.10-23g)
On calcule le volume dont dispose chaque molécule du gaz :
Vdispo = Vballon / N = ____________
On compare ce volume au volume d’une molécule qui vaut : Vmolécule = 5,3.10-29 m3
Interprétation et conclusion :
- Les molécules qui composent un gaz sont très distantes les unes des autres.
- La masse volumique d’un gaz est bien plus faible que celle d’un liquide.
3) Aspect microscopique d’un gaz
L’aspect microscopique d’un gaz est celui d’un ensemble de molécules
indépendantes, très distantes les unes des autres ayant un mouvement
d’agitation permanent.
II. La pression d’un gaz
1) Notion de pression : la force pressante
Les molécules de gaz en agitation subissent des chocs sur les parois du
récipient qui les contient.
Lorsque qu’une molécule de gaz fait un choc sur une paroi
du récipient qui contient le gaz, elle exerce une force sur
cette paroi.
Le résultat de tous ces chocs est une force pressante
que le gaz exerce sur les parois. Cette force est
perpendiculaire à la paroi et dirigée vers l’extérieur.
Expérience : ballon de baudruche dans une cloche à vide (manip. n°1 p.250)
2) Définition de la pression d’un gaz
La force pressante F qu’un gaz exerce sur une paroi
est proportionnelle à la surface S de la paroi.
On note F = P x S avec P qui est la pression du gaz.
La pression est une force par unité de surface :
P = F / S (F en N, S en m2, P en Pa (pascals)

Physique 2nde Chap10 : L’état gazeux
3) Mesure de la pression d’un gaz
Pour mesurer la pression d’un gaz quelconque on utilise un manomètre.
Pour mesurer la pression de l’atmosphère on utilise un baromètre.
Voir Activité p.251
Exercices 13 et 14 p258
L’unité de la pression est le pascal : 1 Pa correspond à une force de 1 N par m2.
On peut aussi utiliser :
- l’hectopascal : 1 hPa = 102 Pa
- le bar : 1 bar = 105 Pa
4) La pression atmosphérique
La pression atmosphérique est la pression de l’air qui nous entoure. Sa valeur
varie et cela influence la météo.
La valeur moyenne de la pression atmosphérique est P0 = 1,013 . 105 Pa
P0 = 1,013 bar = 1013 hPa.
Remarque : la pression atmosphérique correspond à une force de 10 N par cm2 soit
l’équivalent du poids d’une masse de 1 kg par cm2 ! Heureusement, cette pression qui
s’exerce sur notre corps est équilibrée par la pression de l’air contenu à l’intérieur
de notre corps.
III. La température d’un gaz
1) Introduction : chaleur et température
La température d’un corps est une propriété physique de ce corps.
La chaleur est une grandeur physique qui s’échange entre deux corps qui n’ont
pas la même température : un corps à haute température cède de la chaleur à
un corps de température inférieure.
La sensation de froid et de chaud ressentit par le corps humain provient d’un
échange de chaleur avec l’extérieur. Cette sensation permet donc de comparer
des températures* mais pas de mesurer une température.
*Remarque : La chaleur ne s’échange pas de la même façon avec tous les corps
(capacité calorifique) : le bois, le métal...
2) Les thermomètres
Un thermomètre est un appareil qui mesure la température d’un corps.
Un thermomètre utilise un phénomènes physique qui relie la température d’un
matériau à une autre de ses propriétés physiques :
- dilatation d’un liquide (eau, alcool) : variation du volume de liquide en fonction
de sa température
- thermistance : variation de la résistance électrique d’un composant en fonction
de sa température
- émissivité thermique : variation du spectre d’émission d’un corps incandescent
en fonction de sa température
3) La température est une mesure de l’agitation microscopique
La température d’un corps traduit l’agitation microscopique des atomes ou des
molécules qui le constituent : on parle d’agitation thermique.
Plus la température d’un corps est élevé plus la vitesse moyenne d’agitation
des ses atomes ou de ses molécules est grande.
Gaz
Vitesse moyenne à 25 °C
Vitesse moyenne à 100 °C
hélium (He)
1330 m.s-1
1530 m.s-1
dioxygène (O2)
482 m.s-1
539 m.s-1
butane (C4H10)
359 m.s-1
400 m.s-1
4) Echange de chaleur et équilibre thermique
Lorsque deux corps échangent de la chaleur ils se mettent à la même
température. Cet équilibre thermique est un processus qui prend un certain
temps car il correspond à une modification de l’agitation microscopique au sein
de ces deux corps.
1
/
2
100%