notes - WordPress.com

Les changements d’états
La matière se retrouve sur terre sous la forme de trois états :
solide, liquide et gaz. Ils sont caractérisés par leur forme et leur
volume.

L’état de l’eau est en fait fonction de l’agitation de ses molécules
(H2O : molécule renfermant deux atomes d’hydrogène et un
atome d’oxygène).
-A l’état solide, les molécules d’eau sont soudées les unes aux
autres et vibrent très faiblement (d’autant moins que la température de
la glace est basse).
-A l’état liquide, les molécules d’eau sont associées c’est-à-dire
faiblement attachées les unes aux autres.
-A l’état gazeux, les molécules ont seulement une liaison très faible
entre elles ; elles sont animées de mouvements désordonnés.
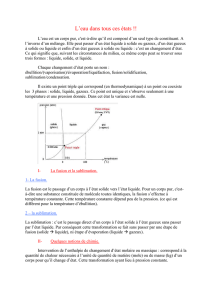
Les changements d'état de l'eau
Le passage d’un état d’agitation moléculaire faible à un état plus élevé
(d'un état de la matière à un autre) impose d’introduire de l’énergie au
sein des molécules (on parle de chaleur). Inversement, le passage
d’un état d’agitation élevé à un état plus faible libère cette chaleur.
L'exemple classique : lorsque je désire faire bouillir de l'eau, pour
cuisiner, je dois allumer la plaque chauffante. En réalité, la plaque
chauffante apporte de l'énergie (chaleur) à l'eau qui l'utilise d'abord
pour augmenter sa température et lorsque toute l'eau liquide est
arrivée à une température de 100°C, l'eau passe alors de l'état liquide
à l'état gazeux (vapeur d'eau).
Ce passage demande que l'on apporte de l'énergie à l'eau.
-Le passage de l’état liquide à l’état gazeux est l’évaporation (l’inverse
la condensation). Ce passage consomme également de l'énergie.
On parle de changements d’états de la matière lorsque l’on passe
d’un état à l’autre.

- Dans une réaction chimique, les changements d’états sont
causés par la rupture et la formation de liaisons.
o Il faut donner de l’énergie pour briser une liaison.
o Former une liaison dégage de l’énergie.
L’énergie absorbée ou libérée lorsqu’une liaison est rompue
ou formée est appelée l’énergie de liaison.
- Il existe deux types de réactions possibles :
- 1. Les réactifs absorbent plus d’énergie que les produits
dégagent.
Réaction endothermique – Le système absorbe de
l’énergie.
(Fusion , vaporisation, sublimation)
2. Les produits dégagent plus d’énergie que les réactifs
absorbent.
Réaction exothermique – Le système dégage de l’énergie.
(cristallisation, la condensation et la solidification)
Ex : 2C2H2(g) + 5O2(g) 4CO2(g) + 2H2O(g) + Énergie

Voici un schéma qui résume les 6 changements d’états :
Exemples :
La glace sèche, est du dioxyde de carbone (CO2) à la
température de -78°C, en se réchauffant, il passe directement
sous forme gazeuse et l'on observe l'apparition de nappe de
brouillard
Les ampoules halogènes : sous l'effet de la chaleur, le tungstène
(symbole W, métal dont est fait le filament) se sublime et peut se
redéposer sous forme solide sur les parois de verre de l'ampoule
(l'ampoule devient opaque) ou à d'autres endroits sur le filament.
L'iode passe de l'état solide à l'état gazeux lorsquʼon le chauffe.
On dit que l'iode se sublime. Le passage de l'état solide à l'état
gazeux sans passage par l'état liquide s'appelle la
SUBLIMATION.
L'iode gazeux qui se recristallise en un solide directement réalise
une condensation solide.

1
/
5
100%