Rapport de Stage

Guillaume Cossard
M2 EFCE
2009/2010
Maîtres de Stage : Michèle Tarayre
Anne Atlan
D
iversit
é
et
structuration g
é
n
é
tiques
des
zones
natives et envahies chez une espèce envahissante :
l’ajonc d’Europe

Je souhaiterais, avant de commencer ce rapport, exprimer mes grands
Remerciements
,
À Michèle Tarayre, pour sa gentillesse doublée d’une extrême patience et d’une ténacité de
tous les jours, même du week-end, pour corriger le même rapport maintes et maintes fois et
trouver la force d’en discuter après.
À Anne Atlan pour ses conseils avisés et sa capacité à toujours orienter la réflexion vers des
axes nouveaux. En somme, je la remercie pour m’avoir communiqué sa passion d’étudier et
de chercher à comprendre un monde extrêmement vaste.
À Benjamin Hornoy pour le heavy qui coule dans ses veines et fait headbanguer sa tête à
l’écoute du nombre de la bête. Je le remercie aussi pour son incrédulité face à mes vaines
tentatives d’ébrécher son impassibilité face aux situations de crise. Car crises il y a eu, et en
nombre, toutes résolues à l’aide seulement d’un peu de braises, de quelques saucisses et de
tanins tous judicieusement dosés. Enfin, je le remercie pour sa magnanimité dans tous les
moments difficiles et pour son aide qui a été plus que généreuse.
À Louis Parize pour sa bonne humeur sans faille et son goût pour la botanique. Merci pour le
ginkgo. Je le remercie aussi pour le partage de sa passion pour les rythmes simples et
sauvages du blues.
Et à ces quatre personnes d’une façon générale pour m’avoir accueilli dans le cadre de ce
stage et m’avoir fait découvrir à quel point les travaux de recherches sont directement
corrélés, comme dirait un statisticien, ou plutôt à la fois favorisés et extrêmement dépendants
d’une volonté de travailler en équipe.
À Annie Guiller pour son implication dans mon travail et toute l’aide qu’elle m’a apportée
sur les méthodes de génotypage et les techniques d’analyse en génétique des populations.
À Dominique Vallet pour sa disponibilité, son affabilité et ses précieux conseils quant à la
composition des multiplexes et de la lecture des génotypes.
À Stéphane Dréano pour son incroyable capacité à être toujours disponible et à donner de lui
pour faire avancer les travaux des autres. Son efficacité n’a d’égal que sa sympathie et sa
faculté à séquencer plus vite que son ombre.
À Valérie Roussel pour l’aide précieuse qu’elle nous apportée quant aux méthodes d’analyse
de la diversité génétique chez les polyploïdes. Les arcanes des logiciels d’analyse génétique
pour les polyploïdes nous seraient restées inconnues si elle n’avait pas été présente.
À tous les collègues du M2 EFCE. A leur esprit de groupe, à leur soutien et aux joies qu’ils
m’ont apportées.

SOMMAIRE
INTRODUCTION .................................................................................................................... 1
MATERIELS ET METHODES ............................................................................................. 5
1. Modèle biologique ...................................................................................................................... 5
2. Sites d’étude et échantillonnage ............................................................................................... 5
3. Caractérisation moléculaire de la diversité génétique ........................................................... 6
3.1. Extraction et purification de l’ADN génomique ................................................................. 6
3.2. Marqueurs moléculaires : microsatellites nucléaires ........................................................... 7
3.3. Amplification de l’ADN ...................................................................................................... 7
3.4. Génotypage .......................................................................................................................... 8
4. Analyses statistiques .................................................................................................................. 9
4.1. Analyse des paramètres de diversité génétique ........................................................................ 9
4.2. Structuration spatiale .............................................................................................................. 10
RESULTATS .......................................................................................................................... 11
1. Diversité génétique .................................................................................................................. 11
1.1. Chez Ulex europaeus ......................................................................................................... 11
1.2. Diversité génétique au sein des populations ...................................................................... 12
1.3. Comparaison de la diversité génétique entre régions et entre zones native et envahie ..... 13
2. Structuration de la diversité génétique .................................................................................. 14
2.1. Indice de différenciation entre populations F’
ST
. ................................................................... 14
2.2. Méthode d’assignation individuelle ....................................................................................... 15
DISCUSSION ......................................................................................................................... 18
1. Diversité et structuration génétiques d’Ulex europaeus dans la zone native ..................... 18
2. Histoire de l’introduction de l’ajonc d’Europe en zone envahie : La Réunion , Nouvelle-
Zélande ............................................................................................................................................. 19
3. Potentiel évolutif de l’ajonc d’Europe dans les zones envahies ........................................... 21
4. Conclusion et Perspectives ...................................................................................................... 22
BIBLIOGRAPHIE ................................................................................................................. 24
ANNEXES

LISTE DES TABLES ET FIGURES
TABLEAU 1 : Situation géographique des 12 populations d’Ulex europaeus échantillonnées. La
distance minimale et la distance maximale entre les populations échantillonnées dans une région
sont indiquées (dist. Min. – dist. Max.). .................................................................................................. 6
TABLEAU 2 : Diversité génétique globale sur l’ensemble des populations étudiées. Sont indiqués : le
nombre d’individus échantillonnés (n), la gamme de taille des allèles, l’étendue et la moyenne du
nombre d’allèles portés par individu, le nombre d’allèles échantillonnés (A
e
), la diversité allélique
(H’
T
), le nombre de phénotypes échantillonnés (N
p
) ainsi que l’indice de diversité phénotypique de
Shannon-Weaver (H
sw
). ......................................................................................................................... 12
TABLEAU 3 : Mesures de diversité génétique (allélique et phénotypique) multilocus pour les 12
populations étudiées, par région, par zone (native et envahie) et totale. Sont présentés le nombre
d’individus génotypés (n), le nombre d’allèles échantillonnés (Ae), la diversité allélique (H’s) et le
nombre moyen d’allèles portés par individu (Aind), le nombre de phénotypes présents (Nh) et
l’indice de diversité de Shannon-Weaver (Hsw). .................................................................................. 14
TABLEAU 4 : Matrice des F’
ST
par paires de régions. Le F’
ST
moyen entre les populations de chaque
région est indiqué dans la diagonale, en grisé. ..................................................................................... 15
Figure 1 : Représentation en arbre des populations sur la base des F’
ST
calculés par paires de
populations. Les populations réunionnaises semblent former un groupe légèrement distinct (cercle
pointillé) des populations des autres régions qui apparaissent toutes mélangées : carrés bleus pour
les populations bretonnes, losanges verts pour les populations écossaises et cercles jaunes pour les
populations néo-zélandaises. ................................................................................................................ 16
Figure 2 : Représentation graphique des proportions d’assignation des individus par inférence
bayésienne à chaque cluster génétique (représentés chacun par une couleur différente) réalisées
sous STRUCTURE, avec K = 9. Chaque barre verticale représente un individu et les populations,
régions et zones d’origine de ces individus sont indiqués. ................................................................... 17

1
INTRODUCTION
Les invasions biologiques sont un des déterminants les plus importants de la perte de
biodiversité auquel on assiste aujourd'hui à l’échelle mondiale. (Sala et al., 2000). En effet, les
espèces envahissantes, c’est-à-dire les espèces qui ont été introduites dans un nouveau milieu et
qui l’ont colonisé, entrent en compétition avec les espèces autochtones, entraînant une perte de
biodiversité dans les zones envahies (Elton, 1958 ; Sakai et al., 2001 ; Lee, 2002 ; Lockwood et
al., 2007). En outre, elles menacent l’intégrité des écosystèmes, les activités de pêche et
d’agriculture, voire même la santé publique (cas d’Ambrosia artemisiifolia, Astéracées ;
Heckel, 1906). Les premières études qui se sont intéressées aux invasions biologiques,
généralement en vue d’un contrôle biologique, ont mis en évidence que seule une minorité des
espèces introduites dans de nouveaux milieux deviennent envahissantes (Williamson, 1996 ;
Jeschke & Strayer, 2005). Ces recherches étaient essentiellement axées sur les processus
écologiques déterminant les invasions : la tolérance des espèces envahissantes et leur plasticité
phénotypique (Williams et al. 1995 ; Sakai et al. 2001 ; Daehler, 2003) ou le relâchement des
pressions biotiques subies par les espèces dans leur zone native (hypothèse nommée « Enemy
release hypothesis » ou ERH ; Jones & Lawton, 1991 ; Keane & Crawley, 2002).
Cependant, les investigations menées sur les espèces envahissantes ont montré que les
invasions étaient la conséquence de la contingence de nombreux facteurs abiotiques et
biotiques, y compris génétiques. Les espèces envahissantes sont le siège de changements
évolutifs (Blossey & Nötzold, 1995 ; Lee, 2002 ; Lee & Gelembiuk, 2008 ; Monty & Mahy,
2009) et le succès envahissant d’une espèce est lié au potentiel évolutif des populations
introduites. Dans ce cadre, l’hypothèse d’évolution de la capacité compétitive (Evolution of
Increased Competitive Ability ou EICA) a été formulée en ces termes par Blossey et Nötzold
(1995) : le relâchement des pressions imposées à une espèce par ses prédateurs et parasites
lorsqu’elle est introduite dans un nouveau milieu entraîne l’évolution de ses traits d’histoire de
vie, vers une allocation moindre d’énergie dans les mécanismes de défense et une allocation
plus importante dans les mécanismes de reproduction et de croissance. Cela conduit à une
compétitivité accrue de l’espèce dans le milieu envahi et favorise son invasion.
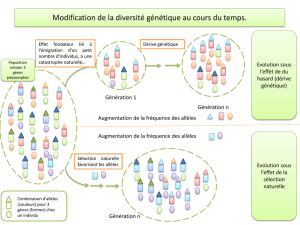
Parce que la variabilité génétique détermine l’évolution d’une population (Fisher, 1930),
il est important de savoir comment les introductions déterminent la diversité génétique
retrouvée dans la zone envahie. Ainsi, de nombreux travaux ont montré comment cette
diversité génétique peut changer après l’introduction (voir Bossdorf et al., 2005, pour revue).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
1
/
34
100%