RESUME DES CARACTERISTIQUES DU PRODUIT 1

RESUME DES CARACTERISTIQUES DU PRODUIT
1. DENOMINATION DU MEDICAMENT
Monuril 3 g granulés pour solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITAVIE
Monuril contient 5,631 g de fosfomycine trométamol, équivalant à 3 g de fosfomycine.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Granulés pour solution buvable.
4. DONNEES CLINIQUES
4.1 Indication thérapeutiques
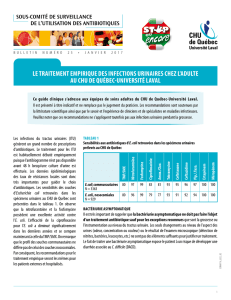
Monuril (fosfomycine trométamol) est indiqué en cas d'infections bactériennes des voies urinaires basses
(cystite), aiguës, non compliquées, chez les adultes, provoquées par des germes sensibles à la
fosfomycine.
Il convient de tenir compte des recommandations officielles concernant l’utilisation appropriée des
antibactériens.
4.2 Posologie et mode d’administration
Posologie
- Pour les infections aiguës, non compliquées des voies urinaires, causées par un germe sensible au
Monuril: 1 sachet de 3 g de fosfomycine en une prise unique.
- Pour les infections aiguës des voies urinaires basses (cystites, urétrites non gonococciques) causées
par des germes sensibles à Monuril, une prise unique du médicament (1 sachet de 3 g) suffit pour
obtenir une guérison.
En cas d’infections persistantes ou récurrentes, un examen plus approfondi s’impose, étant donné que
dans ces cas il s’agit souvent d’affections urinaires compliquées.
Mode d’administration
Monuril doit être dissous dans un demi-verre d’eau et doit être pris de préférence le matin à jeun, le soir
avant le coucher ou 2 à 3 heures avant le repas, toujours après miction.
Patients âgés (> 65 ans)
Aucune adaptation posologique n’est nécessaire, sauf en cas d’insuffisance rénale sévère (voir
rubrique « Insuffisance rénale » ci-dessous et à la rubrique 5.2).
Insuffisance rénale
Monuril – SPC – fr – rev 02/2016 1/9

Aucune adaptation posologique d’une prise unique n’est nécessaire chez les patients présentant une
insuffisance rénale légère à modérée (clairance de la créatine (CrCl) > 10 ml/min) (voir rubrique 5.2).
L’adaptation de la dose peut être nécessaire chez les patients présentant une insuffisance rénale sévère
(clairance de la créatine ≤ 10 ml/min). En raison de données cliniques limitées et d’une augmentation
attendue à l’exposition de la fosfomycine, Monuril doit être utilisé chez ces patients avec précaution (voir
rubrique 5.2).
Insuffisance hépatique
Aucune adaptation posologique n’est nécessaire.
Population pédiatrique
La sécurité et l’efficacité de Monuril chez les enfants âgés de moins de 12 ans n’ont pas été établies.
Aucune donnée n’est disponible.
4.3 Contre-indications
- Hypersensibilité à la fosfomycine ou à l’un des excipients mentionnés à la rubrique 6.1.
- Insuffisance rénale sévère (clairance de la créatinine CrCl < 10 ml/min.).
- Ne pas administrer aux enfants en-dessous de 5 ans.
- Patients sous hémodialyse.
4.4 Mises en garde spéciales et précautions d’emploi
- Des réactions d’hypersensibilité, dont l’anaphylaxie et le choc anaphylactique, peuvent se produire
pendant le traitement avec la fosfomycine, et peuvent être mortelles (voir rubrique 4.8). Si de telles
réactions se produisent, la fosmomycine ne pourra plus jamais être administrée, et un traitement
médical approprié doit être mis en place.
- Des colites associées aux antibiotiques (y compris une colite pseudomembraneuse) ont été rapportées
avec une utilisation d’antibiotiques à large spectre, y compris la fosfomycine trométamol. Par
conséquent, il est important d’envisager ce diagnostic chez les patients présentant une diarrhée sévère
pendant ou après l’utilisation de la fosfomycine trométamol. Dans ce cas, un traitement approprié
doit immédiatement être mis en place. Les médicaments inhibant le péristaltisme sont contre-
indiqués.
- Durant la grossesse et l’allaitement on n’administra seulement Monuril qu’en cas de stricte nécessité
et sous surveillance médicale.
- Prise de nourriture: voir la rubrique “Interactions avec d’autres médicaments et autres formes
d’interactions”.
- Monuril contient du saccharose. L’utilisation de Monuril est déconseillée chez les patients présentant
une intolérance au fructose, un syndrome de malabsorption du glucose/galactose ou un déficit en
sucrase/isomaltase (maladies héréditaires rares).
- Les données sur l’utilisation de Monuril chez les enfants sont limitées. Monuril n’est pas
recommandé chez les enfants de moins de 12 ans.
- En cas d'insuffisance rénale, l'élimination urinaire diminue: des concentrations urinaires efficaces
sont assurées pendant 48 heures avec une Ccr de plus de 10 ml/min. (voir aussi la rubrique 5.2).
- En cas d’insuffisance hépatique, un ajustement de la dose n’est pas nécessaire.
- Chez les patients âgés, la dose recommandée doit être utilisée.
- Dans le cas d’infections persistantes ou récurrentes, il convient d’entreprendre un examen plus
approfondi car dans ces cas, il s’agit probablement d’une affection compliquée des voies urinaires.
Monuril n’est pas indiqué pour le traitement des infections urinaires à germes multi-résistants ou en
cas d’anomalies urologiques.
4.5 Interactions avec d’autres médicaments et autres formes d’interactions
Monuril – SPC – fr – rev 02/2016 2/9

- La prise de nourriture peut ralentir l'absorption de Monuril avec pour conséquence une diminution des
concentrations dans l'urine. C'est pourquoi Monuril doit être pris à jeun ou 2 à 3 heures avant le repas.
- Lorsque le métoclopramide est pris avec la fosfomycine, les concentrations sériques et urinaires
diminuent. D’autres médicaments qui augmentent la motilité gastro-intesinale peuvent provoquer un
effet similaire.
- Les études d’interaction n’ont été réalisées que chez l’adulte.
4.6 Fertilité, grossesse et allaitement
Fertilité
Dans les études chez l’animal, aucun effet sur la fertilité n’a été signalé (voir rubrique 5.3). Il n’y a pas de
données disponibles chez l’homme.
Grossesse
A ce jour, un traitement avec une dose unique ne convient pas comme traitement pour les infections des
voies urinaires chez les femmes enceintes.
Dans les études chez l’animal, aucun effet de toxicité sur la reproduction n’a été signalé (voir rubrique
5.3). Il existe une grande quantité de données concernant l’efficacité de la fosfomycine pendant la
grossesse. Cependant, il n’existe qu’une quantité modérée disponible concernant l’information sur la
sécurité chez la femme enceinte ne démontrant aucune toxicité de la fosfomycine sur les malformations
foeto-/néonatales.
L’utilisation de Monuril pendant la grossesse peut être considérée si nécessaire.
Allaitement
Après l’administration d’une dose unique de fosfomycine, des petites quantités sont excrétées dans le lait
maternel. Dès lors une dose unique peut être utilisée pendant l’allaitement.
4.7 Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Monuril n’a aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
4.8 Effets indésirables
Les effets indésirables les plus fréquents après une prise unique de fosfomycine trométamol touchent le
système intestinal, à savoir la diarrhée. Ceux-ci sont délimités dans le temps et s’estompent
spontanément.
Le tableau ci-dessous présente les effets indésirables rapportés lors de l’utilisation de Monuril au cours
des essais cliniques ou des expériences post-commercialisation.
La fréquence des effets indésirables est définie comme suit : très fréquent (≥ 1/10); fréquent (≥ 1/100,
< 1/10); peu fréquent (≥ 1/1000, < 1/100); rare (≥ 1/10000, < 1/1000); très rare (< 1/10000), fréquence
indéterminée (ne peut être estimée sur base des données disponibles).
Classe de système d’organes Terme préférentiel Fréquence
Affections gastro-intestinales Diarrhée Fréquent
Nausées Fréquent
Dyspepsie Fréquent
Douleurs abdominales Peu fréquent
Vomissements Peu fréquent
Colite associée aux antibiotiques
(voir rubrique 4.4)
Fréquence indéterminée
Infections et infestations Vulvovaginite Fréquent
Affections du système nerveux Maux de tête Fréquent
Monuril – SPC – fr – rev 02/2016 3/9

Étourdissement Fréquent
Paresthésie Peu fréquent
Affections cardiaques Tachycardie Rare
Affections de la peau et du tissu
sous-cutané
Éruption cutanée Peu fréquent
Urticaire Peu fréquent
Prurit Peu fréquent
Angio-oedème Fréquence indéterminée
Troubles généraux et anomalies
au site d’administration
Fatigue Peu fréquent
Affections vasculaires Hypotension Fréquence indéterminée
Affections respiratoires,
thoraciques et médiastinales
Asthme Fréquence indéterminée
Affections du système
immunitaire
Réactions anaphylactiques, y
compris choc anaphylactique,
hypersensibilité
Fréquence indéterminée
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle
permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé
déclarent tout effet indésirable suspecté via le système national de déclaration:
FAGG/AFMPS
Afdeling VigilantieDivision Vigilance
EUROSTATION II
Place Victor Hortaplein, 40/ 40
B-1060 Brussel/Bruxelles
Website/Site internet: www.afmps.be
E-mail: adversedrugreactions@fagg-afmps.be
4.9 Surdosage
L’expérience d’un surdosage oral de la fosfomycine est limitée. Les effets suivants ont été observés chez
les patients après la prise d’un surdosage de Monuril : perte de fonction vestibulaire, déficience auditive,
goût métallique et baisse globale de la perception du goût.
Des cas d’hypotonie, de somnolence, de troubles électrolytiques, de thrombocytémie et
d’hypoprothrombinémie ont été rapportés lors de l’utilisation parentérale de la fosfomycine.
En cas de surdosage, un traitement symptomatique doit être mis en place.
L’élimination urinaire du médicament doit être favorisée par une administration orale adaptée de liquides.
De plus, la prise d’un surdosage de Monuril est en principe impossible, étant donné le conditionnement
de Monuril (1 sachet avec seulement 3 g de fosfomycine).
Population pédiatrique
Les données concernant l’utilisation de Monuril par des enfants sont limitées. L’utilisation de Monuril
n’est pas recommandée chez les enfants de moins de 12 ans.
5. PROPRIETES PHARMACOLOGIQUES
5.1 Propriétés pharmacodynamiques
Classe pharmacothérapeutique: médicament antibactérien, code ATC: J01XX01
Monuril – SPC – fr – rev 02/2016 4/9

Monuril contient le sel fosfomycine trométamol qui est un médicament antibactérien. L'antibiotique actif
est la fosfomycine qui est absorbée par voie orale grâce au sel de trométamol.
Mécanisme d’action
La fosfomycine, en tant que médicament bactéricide, bloque le tout premier stade de synthèse de la paroi
bactérienne par inhibition de l'action d'un enzyme. Ce premier stade de synthèse se situe à l’intérieur du
cytoplasme et c'est pour cela que, pour pouvoir être active, la fosfomycine doit pouvoir pénétrer à
l'intérieur de la bactérie. Elle y parvient en utilisant le système de transport actif L-glycérophosphate.
Chez certaines espèces de bactéries, il existe un second système de transport, notamment celui des
hexoses monophosphates. Ce dernier est inductible et nécessite la présence extracellulaire d’un hexose
monophosphate, p. ex. le glucose-6-phosphate. Son mécanisme d’action spécifique, inhibition spécifique
de l’énolpyruviltransférase, a pour conséquence une absence de résistance croisée avec d’autres classes
d’antibiotiques et la synergie possible avec d’autres antibiotiques.
Effets pharmacodynamiques
La fosfomycine possède une activité à large spectre, sur les germes Gram-positifs et Gram-négatifs, y
compris sur les germes produisant la pénicillinase et sur les germes pathogènes qui sont isolés le plus
fréquemment en cas d’infections des voies urinaires (E. coli, Proteus, Klebsiella, Staphylococcus,
Streptococcus), y compris sur ceux qui sont résistants aux autres substances antibactériennes.
Les valeurs IMC par rapport à la plupart des germes pathogènes responsables d’infections urinaires sont
décrites dans le tableau ci-dessous.
Species MIC50 MIC90
E. coli ≤ 2,0 ≤ 2,0
Citrobacter diversus ≤ 2,0 4,0
Citrobacter freundii ≤ 2,0 ≤ 2,0
Enterobacter aerogenes 16 64
E. agglomerans 16 256
Enterobacter cloacae 16 128
Klebsiella oxytoca 8,0 32
Klebsiella pneumoniae 16 128
Serratia marescens 8,0 32
Proteus mirabilis ≤ 2,0 32
Proteus vulgaris ≤ 2,0 8,0
M. morganii 256 512
Providencia rettgeri 8,0 64
Providencia stuartii 16 128
Acinetobacter spp. 128 512
Pseudomonas aeruginosa 32 64
Stenotophomonas maltophilia 64 128
S. saprophyticus 64 > 512
E. faecalis 32 64
Enterococcus faecium 32 64
Enterococcus durans 32 > 512
Tableau: Activité in vitro de la fosfomycine trométamol vis-à-vis de 3176 isolats bactériens, exprimée
en mg/l de fosfomycine, testée en présence de glucose-6-phosphate (25 mg/l).
La fosfomycine trométamol possède une action bactéricide sur la plupart des bactéries uropathogènes, ce
qui réduit le risque de sélection de germes résistants dans l’urine et dans l’intestin. Il n’existe pas de
résistance croisée entre Monuril et d’autres produits antibactériens.
Les disques pour antibiogrammes sont chargés de 200 µg de fosfomycine et 50 µg de glucose-6-
phosphate. Un diamètre d’inhibition > 16 mm définit les souches sensibles.
Monuril – SPC – fr – rev 02/2016 5/9
 6
6
 7
7
 8
8
 9
9
1
/
9
100%