Capnographie en anesthésie : principes et interprétation

QUESTIONS POUR UN CHAMPION EN ANESTHESIE 85
CAPNOGRAPHIE EN ANESTHESIE
F. Capron, J-L. Bourgain. Service d’anesthésie, Institut Gustave Roussy, 94805
Villejuif Cedex, France.
INTRODUCTION
Le monitorage respiratoire peropératoire par la capnographie, associée à l’oxymé-
trie de pouls (SpO2), la pression dans les voies aériennes, la spirométrie expirée et la
concentration inspirée en oxygène, est à l’heure actuelle une obligation pour toute anes-
thésie générale avec intubation trachéale. Une analyse des accidents d’anesthésie [1],
ayant donné lieu à des plaintes, révèle que 34 % de ces accidents sont d’origine respira-
toire, avec 85 % de décès ou de lésions cérébrales irréversibles. L’expertise conclue
que près de 72 % de ces accidents respiratoires auraient pu être évités par un meilleur
monitorage, essentiellement par la SpO2, la capnographie ou la combinaison des deux.
L’utilisation de la capnographie doit permettre une détection plus précoce des problè-
mes respiratoires afin d’en diminuer la morbidité et la mortalité grâce à une correction
plus rapide. Son intérêt déborde le cadre de l’intubation trachéale pour s’étendre à celui
de la ventilation avec masque laryngé.
En association avec d’autres moniteurs, la capnographie est utile pour le diagnostic
des insuffisances circulatoires et de l’hyperthermie maligne ; elle est utile à l’évalua-
tion de la profondeur d’anesthésie.
1. PRINCIPES DE MESURE
Le CO2 des gaz respiratoires peut être mesuré par différentes méthodes. L’absorp-
tion infrarouge est la méthode actuellement diffusée en France. Elle analyse les
modifications d’absorption par un système optique (le CO2 absorbant sélectivement un
type de longueur d’onde de la lumière infrarouge (4,3 µm)). Les autres méthodes : la
spectrométrie de masse, la spectrographie par effet Raman, la spectrographie photoa-
coustique sont plus onéreuses et ne sont plus commercialisées en France pour le
monitorage clinique.
Selon l’emplacement de la cellule de mesure, on distingue deux types de capnomè-
tres :
1-Le capnomètre aspiratif : la cellule, située dans l’unité principale, est reliée au mala-
de par un tuyau permettant l’aspiration de l’échantillon gazeux. Son intérêt est la
facilité de calibration avec zéro automatique, le faible encombrement au niveau du

MAPAR 199986
patient, ainsi que la possibilité de monitorage de plusieurs gaz (N2O et halogénés). Il
peut être utile pour la surveillance du patient non intubé, en prélevant l’échantillon
soit par un cathéter nasal, soit à travers le masque facial. Lors de l’utilisation de
débits de gaz frais < 1 l.min-1, le gaz inspiré doit être réinjecté dans le circuit filtre à
un emplacement qui n’engendre ni réinhalation, ni artefact de mesure.
2-Le capnomètre non aspiratif : le capteur est situé sur le circuit entre la sonde d’intu-
bation et la pièce en Y. Il évite l’écueil de l’obstruction de la ligne de prélèvement,
notamment en cas d’encombrement bronchique, mais son prix est plus onéreux à
l’achat ou lorsque la cellule doit être remplacée et sa calibration est plus délicate.
2. CHECK-LIST
La vérification avant utilisation est indispensable et est souvent réalisée par un auto-
test de l’appareil. Elle n’identifie pas toujours certains dysfonctionnements comme la
fuite sur la ligne de prélèvement et la perte de linéarité de la cellule de mesure. Les
fuites sont détectées par l’examen de la ligne de prélèvements et certains aspects évo-
cateurs du capnogramme* (un plateau expiratoire descendant ou un plateau long suivi
d’un pic bref, une élévation de la PICO2 avec amortissement de la courbe). Les problè-
mes de non-linéarité des cellules sont difficiles à identifier : la meilleure méthode est
de vérifier régulièrement (ou selon les spécifications des industriels) la mesure de la
concentration de CO2 de deux gaz étalons.
3. CONSIDERATIONS PHYSIOLOGIQUES
Le monitorage du CO2 dans les voies respiratoires permet d’obtenir la pression ins-
piratoire en gaz carbonique (PICO2), la pression télé-expiratoire en gaz carbonique
(PetCO2) et la fréquence respiratoire. La visualisation du capnogramme est indispensa-
ble, car elle permet, en temps réel, de contrôler la qualité de mesure et de pratiquer
certains diagnostics sur l’aspect de la courbe.
La concentration de CO2 dans les alvéoles est un rapport entre le CO2 apporté aux
poumons (VCO2) et la ventilation alvéolaire (VA). L’équation suivante décrit les prin-
cipaux déterminants de la pression partielle alvéolaire en CO2 (PACO2) dans un modèle
uni-alvéolaire et en l’absence de troubles de diffusion de la membrane alvéolo-
capillaire :
PaCO2 = PACO2 = PB x FICO2 + k x VCO2/ VA
où PaCO2 est la pression partielle artérielle en CO2, PB est la pression barométri-
que, FICO2 est la fraction inspirée en CO2, k est une constante.
La PetCO2 est dépendante de la PACO2 et donc influencée par les changements de
la pression atmosphérique, de la FICO2, des déterminants de la VCO2 (la production
tissulaire de CO2 et le transport de CO2 aux poumons), et des déterminants de la venti-
lation alvéolaire (ventilation minute et espace mort physiologique).
4. INTERPRETATION
Elle se fait à plusieurs niveaux : analyse du capnogramme, PICO2 comme témoin
de réinhalation, PetCO2 comme reflet de la pression artérielle en gaz carbonique (PaCO2)
et comme moniteur de la fonction métabolique, respiratoire ou hémodynamique.
(* les hellénistes distingués liront capnigramme)

QUESTIONS POUR UN CHAMPION EN ANESTHESIE 87
4.1. INTERPRETATION DU CAPNOGRAMME NORMAL
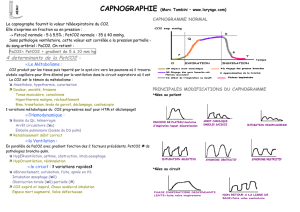
Le capnogramme est divisé en quatre phases (Figure 1) :
1-Phase I : représente la ligne de base inspiratoire, qui doit être stable à zéro.
2-Phase II : est la partie ascendante du capnogramme et correspond à l’apparition du
CO2 au début de l’expiration. L’expiration débute un peu avant cette phase car le gaz
expiré en début d’expiration est dépourvu de CO2, n’ayant pas participé aux échan-
ges gazeux (espace mort instrumental et anatomique). L’ascension est d’autant plus
lente que le poumon est inhomogène et que les alvéoles ont des constantes de temps
longues.
3-Phase III : est la phase de plateau qui correspond au gaz riche en CO2 en provenance
des alvéoles. La valeur de fin de plateau correspond à la PetCO2. Plus la distribution
des rapports ventilation/perfusion (VA/Q) est homogène, plus le plateau est horizontal
.
4-Phase IV : correspond à la descente de la concentration en CO2 et donc au début de
l’inspiration.
4.2. ANOMALIES DU CAPNOGRAMME
Un plateau expiratoire ascendant est évocateur d’un bronchospasme, d’une bron-
chite chronique ou d’une quelconque altération des rapports VA/Q. Cette altération
peut être due soit à un mélange incomplet des gaz (alveolar mixing defect), soit à un
manque de synchronisation entre le pic de ventilation et le pic de perfusion (temporal
mismatching : perfusion maximum en fin d’expiration lorsque la ventilation est la moins
importante).
Le plateau expiratoire peut être altéré par des artefacts synchrones des battements
cardiaques, appelés oscillations cardiogéniques. Elles s’observent en cas de bradypnée
ou de ventilation à faible volume courant et sont souvent reconnues comme des cycles
respiratoires, empêchant le moniteur de s’alarmer devant cette dépression respiratoire.
Le plateau peut être le siège d’une dépression brève, particulièrement en cas de
curarisation partielle, en décubitus latéral et lors des encombrements bronchiques.
Ces aspects évocateurs ne sont en aucun cas spécifiques des pathologies décrites.
Figure 1 : Le capnogramme normal peut être décomposé en quatre phases : I : ligne
de base inspiratoire ; II : montée expiratoire ; III : plateau expiratoire ; IV : descente
inspiratoire. La PetCO2 est la valeur maximale de CO2 mesurée en fin de plateau expi-
ratoire.
Temps
PetCO2
CO2IIIIII IV

MAPAR 199988
4.3. PETCO2 ESTIMATION DE LA PACO2: GRADIENT P(A-ET)CO2
En présence de conditions de mesure correctes : étalonnage effectué, absence de
fuite et fréquence respiratoire < 30 min-1, la PetCO2 permet l’estimation de la PaCO2
chez le sujet sain en ventilation spontanée. Sous anesthésie, en particulier en ventila-
tion mécanique, le gradient P(a-et)CO2 ne peut être négligé.
Ce gradient varie d’un patient à un autre et augmente avec l’âge, le tabagisme, la
classe ASA, la pathologie pulmonaire (surtout en cas d’embolie pulmonaire) et la bais-
se du débit cardiaque. Il n’est pas stable au cours de l’anesthésie, pouvant varier de 4,5
à 13 mmHg [2]. Il est aussi plus faible chez la femme enceinte [3] et chez l’enfant.
L’emplacement de la prise d’échantillon peut influencer le gradient, plus l’empla-
cement est proche du patient, plus le gradient est faible (diminution de l’espace mort
instrumental) [4].
Certaines manœuvres, comme une simple expiration prolongée, ont été proposées
pour réduire P(a-et)CO2[5]. Sur une série de 16 patients devant subir une œsophagec-
tomie thoraco-abdominale, Tavernier et al. [6] ont montré la diminution du gradient
P(a-et)CO2, après une expiration prolongée ou une expiration prolongée précédée d’une
hyperinflation des poumons, celui ci passant de 1,3 ±0,4 kPa à respectivement
0,8 ±0,5 kPa et 0,6 ±0,5 kPa. L’auteur conclue néanmoins que, du fait de l’extrême
variabilité interindividuelle, ces manœuvres ne permettent pas d’améliorer l’évaluation
correcte de la PaCO2 par la PetCO2.
Toutefois, la PetCO2 permet d’identifier les hypercapnies et les hypocapnies les
plus sévères. Un objectif de PetCO2 comprise entre 30 et 35 mmHg, correspond le plus
souvent à une normocapnie (35 à 45 mmHg).
Même chez des patients sans antécédents respiratoires, certaines situations opéra-
toires élargissent le gradient au point de rendre impossible l’extrapolation de la valeur
de PaCO2 à partir de la mesure de PetCO2. C’est ainsi le cas de la position de lomboto-
mie, où le gradient P(a-et)CO2 passe de 4,8 ±3,9 mmHg, en décubitus dorsal, à
7,9 ±3,5 mmHg (p < 0,01), en lombotomie, sans changement hémodynamique nota-
ble [7].
4.4. PICO2: TEMOIN DE REINHALATION
Une PICO2 supérieure à 0 indique une réinhalation du CO2 expiré, et doit faire
suspecter un épuisement de la chaux sodée ou une panne du système d’anesthésie. Son
intérêt est évident en cas d’anesthésie à bas débit de gaz frais (circuit filtre). Il est tout
aussi indispensable avec les systèmes dit ouverts : ils peuvent être sujet à des dysfonc-
tionnements et certains d’entre eux impliquent une réinhalation partielle des gaz expirés
(Mapleson, Circuit de Bain).
4.5. VARIATION DE LA PETCO2 ET DEBIT CARDIAQUE (DC)
Il est maintenant bien démontré qu’il existe une corrélation entre les variations de la
PetCO2 et du DC [8, 9], et cela même pour des DC extrêmement faibles [10]. Deux
mécanismes ont été proposés pour expliquer cette relation entre le DC et la PetCO2: la
diminution de la délivrance du CO2 aux poumons et l’augmentation du nombre d’al-
véoles à haut VA/Q, augmentant le rapport espace mort alvéolaire / volume courant
(Vd/Vt). Cette augmentation du rapport Vd/Vt est en relation avec la diminution du
débit sanguin pulmonaire. La corrélation entre les variations de la PetCO2 et du DC est
la même qu’entre celles de l’élimination du CO2 (VECO2) et du DC (Figure 2 et 3).

QUESTIONS POUR UN CHAMPION EN ANESTHESIE 89
25
20
15
10
5
0
010 20 30 40 50 60 70
% de baisse PetCO
2
Figure 2 : Corrélation entre le pourcentage de baisse du débit cardiaque (% de baisse
du DC) et le pourcentage de baisse de la PetCO2 (% de baisse PetCO2) lors de 33
épisodes de perturbations hémodynamiques. La ligne de régression est tracée ; pente
= 0,33, r2 = 0,82 [9].
y = 0,33x + 0,13 r2 = 0,82
% de baisse de DC
Figure 3 : Corrélation entre le pourcentage de baisse du débit cardiaque (% de baisse
DC) et le pourcentage de baisse de l’élimination du CO2 (% de baisse VECO2) ; pente
= 0,28, r2 = 0,84 [9].
25
20
15
10
5
0
010203040506070
% de baisse VECO2
% de baisse DC
y = 0,28x + 1,44 r2 = 0,84
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%