Inhibiteurs du complexe hélicase

NOUVEAUX ANTIVIRAUX ET VACCINS
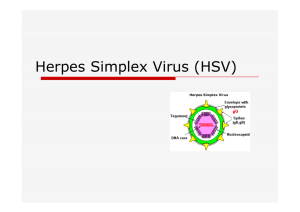
Herpes simplex virus
Dr Sébastien Hantz
Laboratoire de Bactériologie-Virologie-Hygiène
CHU Limoges

Conflits d’intérêts
• Aucun en rapport avec les antiviraux et vaccins HSV

De l’ACV à l’ère des nouveaux
antiviraux…

Historique des anti-HSV
1970 1960 1980 1990 2000 2010 2020 1950
Travaux de Hitchings et Elion
sur les dérivés nucléosidiques
5-iodo-2’déoxyuridine:
1er essai de ttt des
encéphalites herpétiques
Trifluridine: efficace in vitro
mais index thérapeutique trop
faible pour usage systémique
=>ttt kératite
Vidarabine: 1er AV
injectable commercialisé
ACV
1ère publication de la
découverte de
l’acycloguanosine (ACV)
Commercialisaton
de l’ACV
Publication des 1ers
résultats sur des
inhibiteurs du complexe
hélicase-primase
Publication des 1ers
résultats cliniques sur le
pritelivir

Nouvelles approches
pour la chimiothérapie anti-HSV
• Inhibiteurs du complexe hélicase-primase
• Inhibiteurs de la polymérase indépendants de la thymidine
kinase
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
1
/
36
100%





![[PDF]](http://s1.studylibfr.com/store/data/007821614_1-75057d19925517c824dba927bcdc591e-300x300.png)