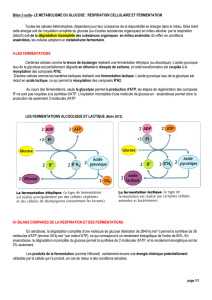
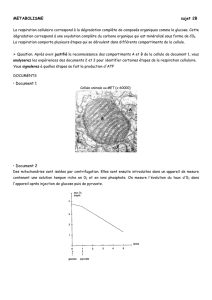
Les sucres et leurs métabolismes

LES SUCRES ET LEURS METABOLISMES
I. GENERALITES SUR LES OSES
A. CLASSIFICATION
Ce sont des dérivés adéhydiques ou cétoniques d’alcools supérieurs poly-hydroxylés.
1. Monosaccharides
Parmi ces oses, l’unité de base qui est obtenue par hydrolyse est le monosaccharide (on ne peut pas
l’hydrolyser davantage).
Les monosaccharides sont classés selon le nombre d’atomes de C : les plus fréquents :
C 3 : trioses
C 5 : pentoses
C 6 : hexoses
parmi ces monosaccharides
cétose : fonction cétone
aldose : fonction aldéhyde
le glucose est un aldohexose
le fructose est un cétohexose.
Problèmes d’isomérie
le glucose est un sucre à 6 C. Il va exister sous 2 formes, D ou L.
Elles sont image de l’une par rapport à l’autre. On est parti à l’origine pour définir les 2 formes du
glycéraldéhyde (le groupement hydroxyle est sur C 2).
Les oses de l’organisme sont de la série D
Pour le glucose :
Les sucres ne sont pas sous forme linéaire mais sous forme cyclique
O
C H
C
CH2OH
HO H
O
CH
C
CH2OH
OHH
L glycéraldéhyde D glycéraldéhyde
O
CH
C
C
OHH
C
C
CH2OH
OH
OH
HO H
H
H
O
C H
C
C
HO H
C
C
CH2OH
HO
HO
OHH
H
H
L glucose D glucose
image de L dans un miroir
C C
HOH
C
C O
C
OH H
HO
H
OH
H
HOH2C
H
a-D-Glucopyranose
O
CH2OH
OH OH
OH
OH

Pour le carbone 1, apparaît des formes d’isomérie : anomère : la position de l’hydroxyle en bas
Cette forme représente 99 % du glucose.
En réalité, dans l’espace, c’est une forme chaise ou bateau.
La forme furanose : 1 %.
L’existence des formes cycliques entraîne l’apparition des anomères a et du glucose : a quand on
représente la fonction OH vers le bas.
Epimères :
ce sont des isomères formés par suite de l’interversion des groupements H et OH sur les C 2 et C 4
du glucose.
sur le C 2 : mannose
sur le C 4 : galactose.
Le glucose est un aldose : le mannose et le galactose également.
Isomérie aldose – cétose.
En biologie le cétose d’intérêt est le fructose : hexose.
cyclisation
forme linéaire
forme furanose
(la plus courante)
2. Dissaccharides
A partir de ces monosaccharides, on va rencontrer des disaccharides d’importance alimentaire.
Ex :
saccharose : a D glucose lié en 1 – 2 à un D fructose. Ce saccharide n’a pas de pouvoir
réducteur.
c’est l’ a D glucose 1 – 2 D fructose.
lactose : D galactose lié en 1 – 4 à un glucose
maltose : 2 molécules de glucose en a 1 – 4.
tréhalose : liaison en 1 – 1 de 2 molécules de a D glucose (a perdu son pouvoir réducteur car
l’adéhyde est impliqué dans la liaison)
3. Oligosaccharides (3 à 6 oses).
4. Polysaccharides : > 6 oses
a) polysaccharide de réserve :
sert à stocker les sucres
amidon (chez les végétaux) : c’est un polymère de glucose lié en a 1 – 4 sur lequel des
branches en a 1 – 6 peuvent se ramifier.
OC*
H
C
OH
H
H H
HO OH
CH2OH
HOH
a-D-Glucofuranose
O
OH
OH
OH
CH2OH
OH
CH2OH
C O
C
C
C
CH2OH
OH
OH
HO H
H
H

glycogène : ramifications beaucoup plus nombreuses : 11 à 18 résidus glucose. Formé de
chaînes de glucoses liées en a 1 – 4 sur lequel des branches en a 1 – 6 sont plus nombreuses
que dans l’amidon.
b) polysaccharides de structure :
cellulose : chaîne branchée en 1 – 4 : bois
chitine : forme la carapace des crustacés : formée d’un dérivé = N acétyl glucosamine liées
entre elles par 1 –4. Sur le C 2, à la place d’un OH on aura une fonction N acétyl
glucosamine (NH-CO-CH3).
c) N acétyl glucosamine et N acétyl galactosamine dans les protéines
Glucose glucosamine N-acétyl glucosamine
Si la substitution a lieu sur une molécule de galactose, on va parler d’une N acétyl
galactosamine. On va le trouver dans les structures glucidiques O liées : beaucoup de protéines
membranaires sont des glycoprotéines : ce sont des protéines qui portent des chaînes
glucidiques plus ou moins longues. Elles sont liées par une liaison covalente qui peut être de 2
types
liée sur l’alcool : souvent entre des molécules de galactose et un résidu sérine ou thréonine
N liée : la liaison se fait entre la fonction alcool du sucre et la fonction amine de l’asparagine
dans la séquence Asp – X – thréonine.
d) Fucose
On le trouve dans les enchaînement glucidiques formant les groupes sanguins.
A partir d’une molécule de galactose fucose.
e) Acide sialique
composé à 10 C : NANA : acide N acétyl Neuraminique. Il possède une fonction carboxylique,
chargé négativement. Il se trouve le plus souvent en position terminale des chaînes glucidiques dans
les glycoprotéines. Les protéines, surtout membranaires, ont souvent des chaînes glucidiques, de 2
types :
N liées : la fixation se fait sur un résidu asparagine de la chaîne protéique : structure glucidique
N liée
liées : la liaison se fait sur OH d’une sérine ou d’une thréonine.
Les séquences de ces sucres sont variables
en général, pour les N liées : commence par 2 NANA puis 3 mannose puis galactose et
glucosamine, a. sialique à la fin.
galactose et galactosamine sont plus fréquents dans les structures O liées.
O
CH2OH
OH
OH
OH
OH
O
CH2OH
OH
OH
NH2
OH
O
CH2OH
OH
OH
NH
OH
C O
CH3
O
CH2OH
OH
OH
NH
O
C O
CH3
Ser
O
CH2OH
OH
OH
NH
N
H
C O
CH3
C
O
Asp
X
Tréo

Les 2 se terminent par un acide sialique en général, apportant une charge négative.
f) Autres composés trouvés dans les chaînes polysaccharidiques
Acide glucuronique
C’est le produit de l’oxydation du C 6 du glucose pour obtenir une fonction carboxylique
CH2OH COOH
On trouve ces acides dans des structures comme les glucosaminoglycanes ou dans les
glucopolysaccharides (composés de longues chaînes riches en sucres aminés et en acides
uroniques) : dans le cartilage et les espaces intercellulaires.
Elles peuvent être liées à des protéines : on parle de protéoglycanes (ex : héparine).
B. ABSORPTION ET DIGESTION DES OSES
1. Digestion des sucres
On absorbe par l’alimentation une grande quantité d’amidon (a 1 – 4 glucose polymérisé) : sucre
lent.
La première action de digestion va avoir lieu au niveau de la bouche c'est à dire la salive, qui
contient une amylase salivaire (ou ptyaline). C’est une enzyme qui va hydrolyser l’amidon en
maltose. Mais son action est généralement faible car sa durée d’action est courte : cette enzyme va
être inhibée lors de l’arrivée dans d’estomac en raison du pH acide.
L’essentiel de l’hydrolyse sera dû à la sécrétion de l’amylase pancréatique qui transforme l’amidon
en maltose ou malto-triose (mélange partiellement digéré). Il reste des branchements 1 – 6 non
hydrolysés par cet enzyme.
Dans l’intestin grêle, d’autres enzymes vont pouvoir intervenir
sucrase : hydrolyse le saccharose (sucre rapide) en fructose et glucose
maltase : maltose 2 glucoses
lactase (sucre du lait) : lactose glucose et galactose (action de la galactosidase)
thréhase : tréhalose glucose.
Pour couper les liaisons a 1 – 6 de l’amidon : intervention de l’isomaltase (1 – 6 glucosidase)
glucose.
Un déficit en lactase peut donner une intolérance au lactose, provoquant des diarrhées.
quelque fois, dans le jeune age et l’age adulte, il a une de la lactase. Certaines personnes ne
supportent plus de boire de lait.
au total on obtient essentiellement du glucose (plus fructose et galactose)
2. Absorption du glucose et des autres oses
a) Glucose
Il y a 2 mécanismes qui vont permettre l’absorption du glucose :
transport actif qui va être couplé avec un transporteur de Na+ et qui fonctionne en synergie avec
la Na-K ATPase.
C’est le système actif, le plus important ; il agit contre un gradient de concentration.
Ce transporteur sodium / glucose est appelé SGLT1 (sodium glucose transporteur 1).
Le SGLT1 transporte le glucose de la lumière intestinale à la cellule intestinale.
Glucose Na+
Glucose
Vers les capillaires
3 Na+
2 K +
2 K +
3 Na+
ATP
ADP

2° mécanisme : nécessite un transporteur qui agit de façon passive : le GLUT5, quand la
concentration dans la lumière est supérieur à celle de la cellule : transport par diffusion simple.
Ensuite, il va falloir faire ressortir le glucose de la cellule pour être pris en charge par le capillaire
du système veineux porte qui va se jeter dans le foie : se fait par un autre transporteur, le GLUT2,
par diffusion passive.
b) Autres oses
Les oses vont aller jusqu’au foie, où la plupart des oses qui ne sont pas du glucose vont être inter
convertis en glucose (souvent le galactose qui ne peut pas être métabolisé directement)
i Galactose
Mécanisme :
La phosphorylation du galactose se fait dans le foie essentiellement, par une galactokinase.
Le galactose 1 P va servir de cosubstrat avec la forme activée du glucose, l’UDP glucose grâce à la
galactose 1 P uridyl transférase. Son absence est à l’origine de la galactosémie du nourrisson.
on transforme un UDPGlucose grâce à une enzyme : uridine diphospho galactose 4 épimérase.
(retourne l’OH en 4)
La majorité est utilisée pour la synthèse de glycogène qui pourra être dégradé jusqu’au G 1 P, puis
grâce à la phospho gluco mutase on aura du G 6 P.
Le G 6 P pourra entrer dans la glycolyse ou donner du glucose libre (sous l’action de la glucose 6
phosphatase).
ii Le fructose
Galactose Galactose 1 P Glucose 1 P Glycocène
UDP Glucose
UDP Glucose UDP Galactose
synthèse de la chaîne
glycosidique des
glycoprotéines
synthèse du lait
ATP ADP UDP galactose 4 épimérase
Galactokinase Gal 1P uridyl
transférase Phospho gluco mutase
Glucose 6 P
Glycolyse Glucose libre
glucose 6 phosphatase
(spécifique du foie et des reins).
Fructose
ATP
ADP Fructose 6 P
Hexokinase
(non spécifique)
isomérase Glucose 6 P
Glucose libre
Glycolyse
Fructokinase Fructose 1 P
Aldolase B
DHAP
glycéraldéhyde
Glycolyse
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%