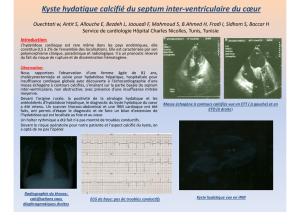
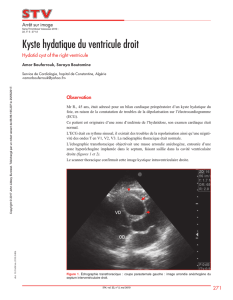
Epidémiologie du kyste hydatique

1
SOMMAIRE:
OBJECTIFS DE LA THESE ................................................................... 7
INTRODUCTION .............................................................................. 8
RAPPELE ANATOMIQUE .................................................................. 10
I/ Le cœur ................................................................................................. 11
A- Généralités .......................................................................................... 11
B- Anatomie de surface. ............................................................................ 14
C- Configuration interne du coeur............................................................. 18
D- la structure histologique du cœur......................................................... 20
E- La vascularisation du cœur ................................................................... 21
F- Le drainage lymphatique....................................................................... 23
II/ La circulation cardio-vasculaire ............................................................... 24
GENERALITES SUR LE KYSTE HYDATIQUE ......................................... 28
I/ Epidémiologie du kyste hydatique : ............................................................... 29
A- Affection cosmopolite. ......................................................................... 29
B- Répartition géographique du kyste hydatique dans le monde ................ 30
II/ Parasitologie des Echinococcoses............................................................. 32
A- Les différentes variétés d’Echinococcus granulosus .............................. 32
1) Echinococcus granulosus granulosus ................................................ 33
2) Echinococcus granulosus equinus ..................................................... 34
3) Echinococcus granulosus canadensis et boréalis ............................... 34

2
B- Description morphologique .................................................................. 34
1) La forme adulte ................................................................................ 35
2) La forme ovulaire ............................................................................. 37
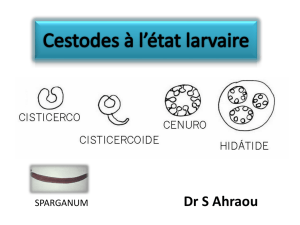
3) la forme larvaire ou kyste hydatique ................................................. 37
C- Le cycle parasitaire ............................................................................... 42
1) Le cycle naturel ................................................................................ 42
2) Le cycle chez l’homme ..................................................................... 43
III/ Les différentes localisations du kyste hydatique. ......................................... 46
A- La localisation hépatique ...................................................................... 46
B- La localisation pulmonaire. ................................................................... 46
C- Les autres localisations ........................................................................ 47
OBSERVATION ............................................................................... 48
REVUE DE LA LITTERATURE ........................................................... 64
I/ Epidémiologie du kyste hydatique du coeur ............................................... 65
A- La Fréquence de la localisation cardiaque ............................................. 65
B- Répartition âge/sexe ............................................................................ 65
II/ Physiopathologie de l’hydatidose cardiaque ................................................ 66
A- Le mécanisme de l’infestation du cœur ................................................. 66
B- Les différentes voies de l’atteinte cardiaque .......................................... 67
1) La voie veineuse ............................................................................... 67
2) La voie artérielle ............................................................................... 67
3) La voie lymphatique. ........................................................................ 68

3
C- La fréquence des différentes localisations cardiaques .................................. 68
1) Au niveau des cavités cardiaques ...................................................... 68
2) Au niveau de la paroi cardiaque ........................................................ 69
III/ Etude anatomopathologique ................................................................... 70
A- Les lésions anatomopathologiques ....................................................... 70
B- L’évolution naturelle du kyste hydatique du cœur ................................. 71
1) Augmentation lente et progressive du volume du kyste ..................... 72
2) La fissuration du kyste ..................................................................... 72
3) La rupture du kyste hydatique ......................................................... 72
4) L’involution ...................................................................................... 73
IV/ Signes cliniques de l’hydatidose cardiaque .............................................. 74
A-les formes asymptomatiques ................................................................. 74
B- Les formes symptomatiques ................................................................ 75
1) Les signes fonctionnels .................................................................... 75
2) Les signes physiques. ....................................................................... 77
V/ Complications et Symptômes .................................................................. 77
A- La Fissuration et la rupture ................................................................... 78
1) La rupture intracavitaire. .................................................................. 78
2) La rupture intrapéricardique ............................................................. 81
3) La rupture intramyocardique. ........................................................... 82
B- Les complications mécaniques .............................................................. 82
1) La compression coronarienne ........................................................... 82
2) Les dysfonctionnements valvulaires .................................................. 83
3) Complications plus rares .................................................................. 83
C- Les troubles du rythme et de la conduction .......................................... 84
1) les troubles conductifs ..................................................................... 84

4
2) Les troubles rythmiques ................................................................... 85
D- L’infection du kyste.............................................................................. 85
VI/ Les moyens du diagnostic paraclinique ................................................... 86
A- L’imagerie médicale ............................................................................. 86
1) La radiographie thoracique. .............................................................. 86
2) L’échocardiographie ......................................................................... 88
a) Matériels et méthodes .................................................................. 88
b) Résultats ..................................................................................... 88
c) Diagnostic positif ......................................................................... 88
3) Le scanner et l’imagerie par résonance magnétique .......................... 92
4) La coronaroventriculographie ........................................................... 95
B- Le diagnostic biologique de l’hydatidose............................................... 96
1) Les examens non spécifiques .......................................................... 96
a) L’hyperéosinophilie. ..................................................................... 96
b) Augmentation de IgE totales ........................................................ 97
c) Bilan de retentissement et d’extension aux autres organes.............97
2) Les examens spécifiques ................................................................. 97
a) Dosage des IgE spécifiques .......................................................... 98
b) Les Réactions sérologiques ou la sérodiagnostic .......................... 98
c) L’interprétation des résultats...................................................... 100
d) autres moyens biologiques du diagnostic. .................................. 101
C- Les troubles de l’électrocardiogramme ............................................... 101
1) Les troubles de rythme ................................................................... 102
2) Les troubles de la repolarisation ..................................................... 102
3) Les anomalies de la conduction ...................................................... 102
4) Les ondes Q ................................................................................... 102

5
VII/ Traitement du kyste hydatique du cœur .................................................. 104
A- Traitement chirurgical ........................................................................ 104
1) Généralités ..................................................................................... 104
2) La circulation extracorporelle ......................................................... 105
a) Définition .................................................................................. 105
b) Principe ..................................................................................... 105
c) Composants et matériels ............................................................ 106
d) Installation de la circulation extracorporelle ............................... 107
e) La décompression ventriculaire gauche. ..................................... 108
f) La cardioplégie ........................................................................... 108
g) Cell saver .................................................................................. 108
3) Conduite de la circulation extracorporelle ....................................... 109
a) Préparation. ............................................................................... 109
b) Monitorage ................................................................................ 109
c) Amorçage du circuit. .................................................................. 109
d) Départ de la circulation extracorporelle ...................................... 110
e) Clompage aortique et protection myocardique ........................... 110
f) Arrêt de la circulation extracorporelle ......................................... 110
4) Les techniques chirurgicales ........................................................... 111
a) La cystopéricystectomie ............................................................. 112
b) La périkystectomie ..................................................................... 112
5) Les complications de la résection chirurgicale ................................. 114
6) Les solutions scolécides. ................................................................ 115
B- Traitement médical............................................................................. 116
1) L’intérêt du traitement médical. ...................................................... 116
2) les indications du traitement médical .............................................. 118
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
1
/
152
100%